
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
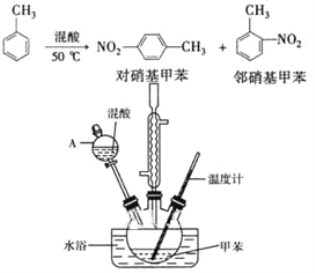
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_______________________。反应中需不断搅拌,目的是__________________________________________。
(2)仪器A的名称是______,使用该仪器前必须进行的操作是____。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_____。
(4)分离反应后产物的方案如下:

其中,操作1的名称为______,操作2中需要使用下列仪器中的____(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为______(保留4位有效数字)。
【答案】 分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌; 使反应充分进行,并防止温度过高有其他副产物生成 分液漏斗 检查是否漏液 温度过高,导致HNO3大量挥发 分液 abc 70.25%
【解析】⑴. 配制混酸时,分别量取10mL和30mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅的情况。搅拌的目的是为了使反应充分进行,并防止温度过高有其他副产物生成;
故答案为:分别量取10mL和30mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌;使反应充分进行,并防止温度过高有其他副产物生成;
⑵. 仪器A是分液漏斗,使用前必须检查是否漏液;故答案为:分液漏斗;检查是否漏液;
⑶. 若实验后在三颈瓶中收集到的产物较少,可能的原因是温度过高,导致HNO3大量挥发,故答案为:温度过高,导致HNO3大量挥发;
⑷. 因为分离得到的是无机和有机两种液体,而有机物和无机物是不相溶的,因此方法是分液;分离两种硝基化合物只能利用它们沸点的不同,因此采用蒸馏的方法,使用到所提供仪器中的分别是:酒精灯、温度计、冷凝管;故答案为:分液;abc;
⑸. 产率的计算方法是用实际产量除以理论产量,根椐方程式,1mol的甲苯可以得到1mol的对硝基甲苯与1mol的邻硝基甲苯,换算成质量应该是:92g的甲苯可以得到137g的对硝基苯和137g的邻硝基苯,则13g的甲苯可得到的一硝基苯的质量是: ![]() =19.35g,所以一硝基苯的产量为:
=19.35g,所以一硝基苯的产量为: ![]() ×100%=70.25%;故答案为:70.25%.
×100%=70.25%;故答案为:70.25%.


科目:高中化学 来源: 题型:
【题目】1mol甲烷和氯气发生取代反应,待反应完成后,测得四种取代物的物质的量相等,则消耗氯气的物质的量为
A.0.5molB.2molC.2.5molD.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是: 2Cu2O+Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为________;Cu2O与Cu2S比较,熔点较高的是_____,原因是________。.
(2)SO2与SO3的健角相比,键角更大的是_____,将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1,此固态SO3中S原子的杂化轨道类型是_________;该结构中S-O键长有两类。一类键长约140pm,另一类键长月为160pm,较短的键为_______。(填图中字母)
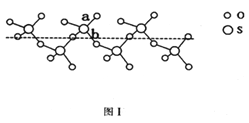
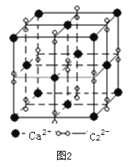
(3)离子化合物CaC2的一种晶体结构如图2所示。该物质的电子式_____。从钙离子看,属于________堆积,其配位数是_________;一个晶胞含有的π键平均有________个。
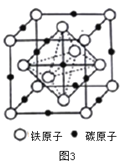
(4)奥氏体是碳溶解γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为________pm (阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为_________
(2)③的反应试剂和反应条件分别是________,该反应的类型是________。
(3)⑤的反应方程式为_____吡啶是一种有机碱,其作用是______。
(4)G的分子式为___________
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇与乙酸在浓硫酸作用下的反应装置如图(酒精灯等在图中均已略去)。试管b中盛有________溶液。加热一段时间后,试管b溶液上方有一层油状液体,该油状液体的名称是_________。乙醇与乙酸反应的化学方程式为__________________________________
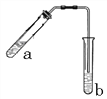
(2)某待测液中可能含有Al3+、Fe3+、Na+、NH4+、Cl-等离子,现通过如下实验对其中的阳离子进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中逐滴滴加NaOH溶液至过量,先有白色沉淀生成,后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_____,一定没有的阳离子是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途错误的是( )
A.水玻璃用作木材防火剂
B.高纯度的硅是制造光导纤维的材料
C.可用氢氟酸刻蚀玻璃
D.氢氧化铝、小苏打可用于治疗胃酸过多症
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
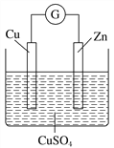
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 一个苯分子含3个π键和6个σ键
B. 金属的导电性、导热性、延展性都与自由电子有关
C. C2H2分子中σ键与π键的数目比为1∶1
D. 水加热到很高温度都难分解是因水分子间存在氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com