
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
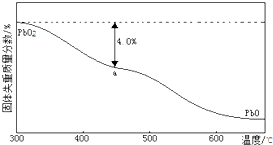
| ||
| ||
| 2-x |
| 2 |
| 2-x |
| 2 |
| 2m+n |
| m+n |


科目:高中化学 来源: 题型:
| A、含有肽键的有机化合物遇到双缩脲试剂会产生紫玫瑰色,葡萄糖与新制氢氧化铜悬浊液混合出现绛蓝色 |
B、2,3-二甲基戊醛的键线式为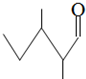 |
C、化合物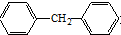 是苯的同系物 是苯的同系物 |
D、S-诱抗素的结构简式为: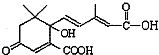 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH 则l mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Ca2+、SO42-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、废发泡塑料饭盒是造成环境“白色污染”的污染源之一 |
| B、价廉、质轻、保温性能好 |
| C、适用于微波炉加热食品 |
| D、不适于盛放含油较多的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业制硫酸时,设置“废热”锅炉产生蒸气,用于发电 |
| B、开采更多的能源,提高能源开采量 |
| C、燃烧煤的锅炉采用类似沸腾炉的锅炉 |
| D、推广使用乙醇汽油从而减轻大气污染,改善大气环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com