
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定混合气体中含有乙烯和SO2。
(1)(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中盛放的试剂分别是________(可重复使用,填字母)。
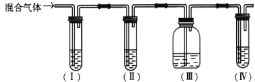
A.品红溶液 B. NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是_________________。
(3)使用装置Ⅱ的目的是_________________。
(4)使用装置Ⅲ的目的是_________________。
(5)确定含有乙烯的现象是_________________。
【答案】ABAD 装置I中品红溶液颜色变浅或褪去 除去SO2气体 检验SO2是否除尽 装置(Ⅲ)中品红溶液不褪色,装置(Ⅳ)中酸性KMnO4溶液褪色
【解析】
(1) SO2能使品红溶液褪色,用品红溶液检验SO2;乙烯、二氧化硫都能使酸性KMnO4溶液褪色,所以先检验二氧化硫,然后除去二氧化硫,再检验产物中有乙烯;
(1)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液检验乙烯,故(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中盛放的试剂分别是品红溶液、氢氧化钠溶液、品红溶液、酸性高锰酸钾溶液;
(2) SO2能使品红溶液褪色,(I)中品红溶液褪色变变浅能说明SO2气体存在。
(3)二氧化硫与氢氧化钠溶液反应,装置Ⅱ盛装氢氧化钠溶液,可以除去乙烯中的SO2气体。
(4)装置Ⅲ中盛放品红溶液,可以检验SO2是否除尽。
(5) 若装置(Ⅲ)中品红溶液不褪色、装置(Ⅳ)中酸性KMnO4溶液褪色,则可以确定含有乙烯。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是( )
A.同温同压下,NA个NO气体与NA个N2和O2的混合气体的体积相等
B.标准状况下,22.4LCCl4所含分子数为NA
C.4℃时,9mL水和标准状况下11.2L氮气含有相同的原子数
D.1.7gH2O2中含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
B. 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种
C. 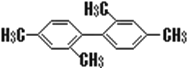 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
D. 1mol有机物 一定条件下能和7molNaOH反应。
一定条件下能和7molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是
A. [Co(NH3)6]Cl3中Co的化合价是+3B. H2O2 的电子式:![]()
C. NH3和NH4Cl化学键类型相同D. 中子数为32,质子数为27的钴原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
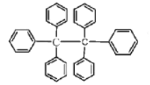
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 核磁共振氢谱有3组峰
D. 它的分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )
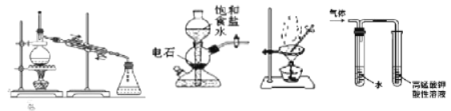
A. 提纯工业乙醇(含甲醇、水等杂质)的装置①
B. 实验室中若需制备较多量的乙炔可用装置②
C. 提纯含苯甲酸钠杂质的粗苯甲酸选择装置③
D. 检验溴乙烷与NaOH乙醇溶液加热制得的气体选择装置④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室用CH3COOH (60g/mol)和CH3CH2CH2CH2OH(74g/mol)在浓硫酸加热条件下制备乙酸正丁酯(116g/mol)。
主要实验步骤如下:


Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.25g,0.125mol)正丁醇、7.2mL(12.0g,0.2mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层
②将酯层倒入小锥形瓶中,加少量无水硫酸镁
③过滤,将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:

根据以上信息回答下列问题:
(1)制备乙酸正丁酯的化学方程式为:__________________________________ ,制备过程中易生成副产物正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3),该副反应的化学方程式为:___________。
(2)图1整个装置可看作由分水器、圆底烧瓶和______(填仪器名称)组成,其中冷水应从______(填a或b)管口通入.分水器可将生成的水从反应体系中分离出来,有利于______,如何判断该合成反应达到了终点:_____________________。
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住旋塞将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②加入无水硫酸镁的作用是________ 。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(双选)。
A.水B.甘油(沸点290℃) C.砂子D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有______杂质。
(5)反应结束后,生成11.6g乙酸正丁酯,则正丁醇的转化率约为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com