
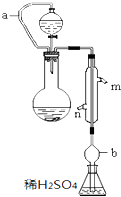
 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
分析 (1)根据信息,圆底烧瓶内为碱性溶液中蒸馏氨,即铵根与碱加热反应生成氨气和水,据此离子书写方程式;
(2)依据装置图根据保证漏斗中的液体滴入锥形瓶中即要保持烧瓶和漏斗内压强恒定分析导管a的作用;根据氨气极易溶于酸分析b的作用;
(3)根据实验原理:总硫酸的量减去未反应的硫酸的量即得到吸收氨气消耗的硫酸的量,从而计算氨气的量,最终计算总氮含量,所以会使所测总氮含量偏小即滴定未反应的硫酸的量则要偏大,据此分析;
(4)若实验操作均正确,但测定结果偏低,则说明吸收氨气不完全,据此分析;
(5)根据实验原理:总硫酸的量减去未反应的硫酸的量即得到吸收氨气消耗的硫酸的量,从而根据2NH3+H2SO4=(NH4)2SO4计算氨气的量,最后再根据肥料中总氮含量=$\frac{m(氮元素)}{m(总)}$×100%进行计算.
解答 解:(1)根据信息,圆底烧瓶内为碱性溶液中蒸馏氨,即铵根与碱加热反应生成氨气和水,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)依据装置图必须保证漏斗中的液体滴入锥形瓶中,则就要保持烧瓶和漏斗内压强恒定,所以a的作用为保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中;因为氨气极易溶于酸,所以吸收时要注意防倒吸,则b的作用为防止锥形瓶中的溶液倒吸,故答案为:保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中;防止锥形瓶中的溶液倒吸;
(3)根据实验原理:总硫酸的量减去未反应的硫酸的量即得到吸收氨气消耗的硫酸的量,从而计算氨气的量,最终计算总氮含量,所以会使所测总氮含量偏小即滴定未反应的硫酸的量则要偏大,
A.锥形瓶水洗后未烘干,待测液中溶质无损失,对滴定实验无影响,故错误;
B.滴定过程中滴定管有漏水现象,即滴定计算消耗的氢氧化钠偏多,所以测得的硫酸偏大,故正确;
C.滴定过程中有少量溶液从锥形瓶中溅出,即滴定计算消耗的氢氧化钠偏少,所以测得的硫酸偏小,故错误;
D.滴定前滴定管内有气泡,滴定后没有了,即滴定计算消耗的氢氧化钠偏多,所以测得的硫酸偏大,故正确;
故选:BD;
(4)若实验操作均正确,但测定结果偏低,则说明吸收氨气不完全,所以可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收,故答案为:仍有氨气残留在装置中未被锥形瓶中的硫酸吸收;
(5)消耗氢氧化钠溶液体积平均=$\frac{5.22-0+11.18-6.00+17.20-12.00}{3}$=5.20ml;
2NaOH~H2SO4
2 1
0.00520L×0.1000mol/L n
n=0.00026mol;
则剩余硫酸为0.00026mol,所以和氨气反应的硫酸=0.0250L×0.500mol/L-0.00026mol=0.01224mol;
2NH3+H2SO4=(NH4)2SO4,
2 1
n(NH3) 0.01224mol
n(NH3)=0.02448mol;
肥料中总氮含量为=$\frac{0.02448mol×14g/mol}{1.200g}$×100%=28.6%,故答案为:28.6%.
点评 本题考查了实验装置的分析和滴定实验的基本操作及注意问题,误差分析和计算方法分析应用,滴定过程的分析判断和计算是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
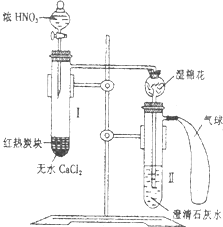 某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.
某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷中加入硝酸银溶液:Cl-+Ag+═AgCl↓ | |
| B. | 溴乙烷与氢氧化钠水溶液共热:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| C. | 丙烯聚合:nCH2═CHCH3$→_{△}^{催化剂}$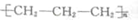 | |
| D. | 苯酚钠溶液中通入少量二氧化碳: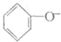 +CO2+H2O→ +CO2+H2O→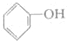 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 A、B 组成的化合物常温下一定呈气态 | |
| B. | 元素 D 的最高价氧化物对应的水化物不是两性化合物 | |
| C. | 元素 C 的最高价氧化物对应的水化物是弱碱 | |
| D. | 化合物 AE 与 CE 有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com