
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
分析 A.碳酸钠滴入H2SO4发生反应:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O;硫酸滴入碳酸钠发生反应:2Na2CO3+H2SO4═Na2SO4+2NaHCO3、2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O;
B.氯化铝滴入氢氧化钠发生反应:Al3++4OH-=AlO2-+2H2O、Al3++3AlO2-+6H2O=4Al(OH)3↓;氢氧化钠滴入氯化铝发生反应:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
C.偏铝酸钠滴入硫酸发生反应:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓,2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;硫酸滴入偏铝酸钠发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓,3H2SO4+2Al(OH)3═Al2(SO4)3+6H2O;
D.NaHCO3和Ba(OH)2反应生成沉淀.
解答 解:A.碳酸钠滴入H2SO4发生反应:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O,现象立刻产生气泡;硫酸滴入碳酸钠发生反应:2Na2CO3+H2SO4═Na2SO4+2NaHCO3、2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O,现象开始无气泡,一段时间后有气泡,所以二者现象不同,故A不选;
B.因前者逐滴滴入后者,发生AlCl3+4NaOH═3NaCl+NaAlO2+H2O、3NaAlO2+AlCl3+6H2O═4Al(OH)3↓+3NaCl,现象为先没有沉淀后有沉淀生成;而后者逐滴滴入前者发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,现象为先有沉淀生成后沉淀逐渐消失,则现象不同,故B不选;
C.偏铝酸钠滴入硫酸发生反应:2NaAlO2+4H2SO4+2H2O=Na2SO4+Al2(SO4)3+4H2O,现象为开始无沉淀,后产生白色沉淀;硫酸滴入偏铝酸钠发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓,3H2SO4+2Al(OH)3═Al2(SO4)3+6H2O,现象开始产生沉淀,后沉淀溶解,二者现象不同,故C不选;
D.NaHCO3和Ba(OH)2反应发生NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,发生反应及现象与加入顺序无关,故D选;
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考会从,注意利用滴加顺序不同来判断反应的现象,明确发生的化学反应是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 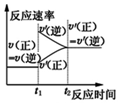 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| B. | 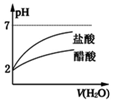 将pH=2的盐酸和醋酸分别加水稀释 | |
| C. | 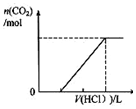 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 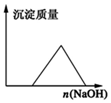 在AlCl3溶液中滴入NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | Cl2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | MgCl2 |
| D | CO2 | SO2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水22g,其中所含的中子数为11 NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4 L,质量为28 g | |
| C. | 标准状况下,22.4LNO和11.2L O2混合后气体的原子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
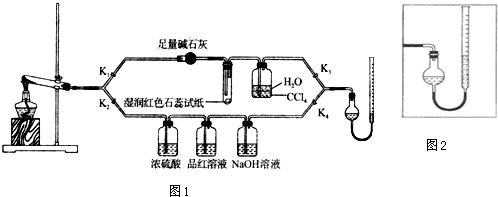
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
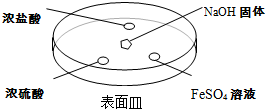
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com