
分析 根据n=$\frac{N}{{N}_{A}}$结合物质的分子、原子构成计算该题.
解答 解:①N(H)=0.5mol×2×6.02×1023/mol=6.02×1023,故答案为:6.02×1023;
②N(Na+)=1mol×6.02×1023/mol=6.02×1023,故答案为:6.02×1023;
③N(H)=2mol×6.02×1023/mol=.204×1024,故答案为:.204×1024;
④n(H2O)=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}/mol}$=2mol,n(H)=2n(H2O)=4mol,故答案为:4mol;
⑤n(Fe)=$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}/mol}$=1.5mol,故答案为:1.5mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的构成特点以及相关计算公式的运用,难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
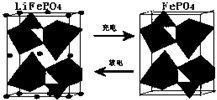
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
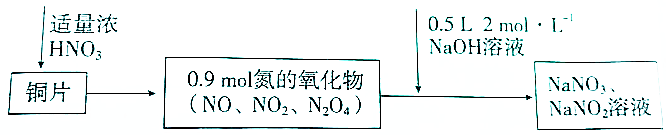
| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com