
| A. | 向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-═2C6H5OH+CO32- | |
| D. | 向40mL0.5mol/LFeBr2溶液中通入448mLCl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
分析 A.反应生成氢氧化铁沉淀;
B.至SO42-恰好沉淀完全,反应生成硫酸钡、偏铝酸钾;
C.反应生成苯酚和碳酸氢钠;
D.n(FeBr2)=0.04×0.5mol/L=0.02mol,n(Cl2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒及氧化的先后顺序可知,亚铁离子全被氧化,溴离子一半被氧化.
解答 解:A.向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体的离子反应为2Fe2++3Na2O2+4H2O═6Na++2Fe(OH)3+O2↑+2OH-,故A错误;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故B错误;
C.苯酚钠溶液中通入少量CO2的离子反应为CO2+H2O+C6H5O-═C6H5OH+HCO3-,故C错误;
D.n(FeBr2)=0.04×0.5mol/L=0.02mol,n(Cl2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒及氧化的先后顺序可知,亚铁离子全被氧化,溴离子一半被氧化,离子反应为2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项AD为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3s1和3s23p4 | B. | 3s23p4 和2s22p4 | ||
| C. | 3s2和2s22p5 | D. | 2s22p2 和2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,据此填写下列空格.
,据此填写下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
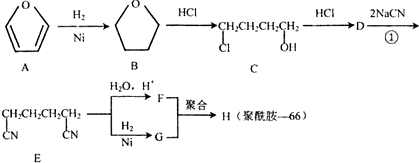
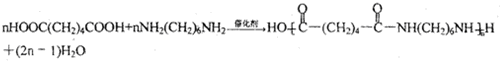 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com