
【题目】半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3 , 装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5和HCl,遇O2会生成POCl3 , POCl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | ﹣112 | 75.5 |
PCl5 | 2 | 105.3 |
请回答下列问题
(1)装置中制氯气的离子方程式为
(2)B中的试剂是 , E中次冷水的作用是 , F中碱石灰的作用是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2 , 再迅速加入黄磷.通干燥CO2的作用是通过控制K1、K2能除去A、B装置中的空气,具体的方法是
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5 , 通过(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是 .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应
(3)排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1 , 打开K2 , 等B中溶液上方充满黄绿色气体后,打开K1 , 关闭K2
(4)蒸馏
(5)溶液由蓝色变为无色,且半分钟内不变色;0.8%
【解析】解:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应.(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应,所以答案是:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应;(3)由于PCl3遇O2会生成POCl3 , 遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1 , 打开K2 , 等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1 , 关闭K2 , 所以答案是:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1 , 打开K2 , 等B中溶液上方充满黄绿色气体后,打开K1 , 关闭K2;(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离, 所以答案是:蒸馏;(5)②碘遇淀粉显蓝色,用0.1mol/L的Na2S2O3溶液滴定溶液中的碘,当碘反应完毕时,溶液的蓝色会褪色,所以滴定终点的现象为溶液由蓝色变为无色,且半分钟内不变色,所以答案是:溶液由蓝色变为无色,且半分钟内不变色;③0.1000molL﹣1碘溶液10.00mL中含有碘单质的物质的量为:0.1000molL﹣1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol﹣0.1000molL﹣1×0.00084L×
Mn2++Cl2↑+2H2O;(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应,所以答案是:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2 , 防止空气中的水蒸气进入烧瓶和PCl3反应;(3)由于PCl3遇O2会生成POCl3 , 遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1 , 打开K2 , 等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1 , 关闭K2 , 所以答案是:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1 , 打开K2 , 等B中溶液上方充满黄绿色气体后,打开K1 , 关闭K2;(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离, 所以答案是:蒸馏;(5)②碘遇淀粉显蓝色,用0.1mol/L的Na2S2O3溶液滴定溶液中的碘,当碘反应完毕时,溶液的蓝色会褪色,所以滴定终点的现象为溶液由蓝色变为无色,且半分钟内不变色,所以答案是:溶液由蓝色变为无色,且半分钟内不变色;③0.1000molL﹣1碘溶液10.00mL中含有碘单质的物质的量为:0.1000molL﹣1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol﹣0.1000molL﹣1×0.00084L× ![]() =0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mL三氯化磷水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol×
=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mL三氯化磷水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol× ![]() =0.0058mol,所以100g产品中含有的三氯化磷的物质的量为0.0058mol,该产品中PCl3的质量分数为:
=0.0058mol,所以100g产品中含有的三氯化磷的物质的量为0.0058mol,该产品中PCl3的质量分数为: ![]() ×100%=0.8%;所以答案是:0.8%.
×100%=0.8%;所以答案是:0.8%.


科目:高中化学 来源: 题型:
【题目】X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
X | 原子的最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
T | 与Z同周期,元素最高价是+7价 |
W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是;W元素基态原子电子排布式为 .
(2)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为 , 它所形成的晶体类型为; Y的常见氢化物易液化的主要原因是
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4.4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为 . ②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 一种工业合成氨的简式流程图如下: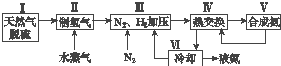
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤Ⅱ中制氢气的原理如下:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4 kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 .
a.升高温度b.增大水蒸气浓度 c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量.若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO的转化率为 .
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: .
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图 . 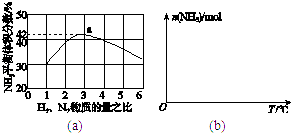
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) . 简述本流程中提高合成氨原料总转化率的方法:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~G有如图所示转化关系(部分生成物没有列出).其中A是常见的金属单质,E、F是气体.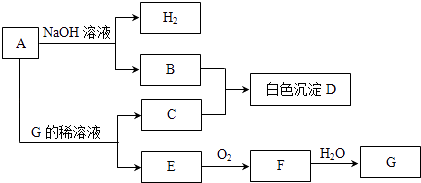
请回答下列问题:
(1)写出下列物质的化学式:A、D、G;
(2)B和C反应生成D的离子方程式为;
(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为;
(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,则E和F的体积比为 .
(5)等体积的E、F通入NaOH溶液中可生成盐和水,反应的化学方程式为 . 室温下,0.1mol/L的上述盐溶液pH=8.3,原因是(用离子方程式表示)该溶液中所有离子按浓度由大到小排列的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L的密闭容器中同时充入6mol H2和2molN2 , 2min末测得生成NH3 1.2mol,前2min内用N2表示的平均反应速率是 , H2的转化率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 合金的熔点一般比各成分金属的熔点高
B. 生铁的硬度比纯铁的硬度大
C. 胶体区别与其他分散系的本质特征是能发生丁达尔现象
D. 因为氯气溶于水可以导电,所以氯水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现血红色的是
A. FeOB. Fe2O3
C. FeCl3D. Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是( )
A. 热稳定性:H2O>NH3>PH3
B. 原子半径:Si>Na>O
C. 碱性: CsOH>KOH>NaOH
D. 失电子能力:K>Na>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 氮氧化物可导致光化学烟雾
D. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com