
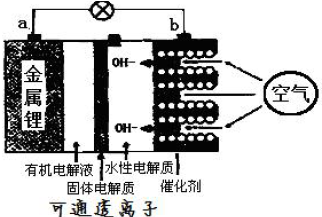
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
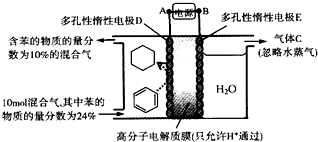
| A. | 多孔性惰性电极E为电解池的阴极 | |
| B. | 装置中气体C为氢气 | |
| C. | 由A至D,导线中电子转移方向为D→A | |
| D. | 装置中阴极的电极反应式为C6H6+6H++6e-═C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
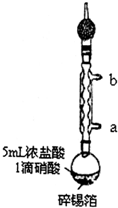 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
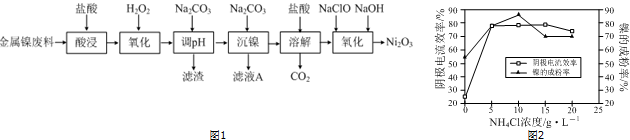
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电太阳能电池使用的高纯硅在工业生产过程中实现了零污染 | |
| B. | 生物质能来源于植物及其加工产品贮存的能量,姑动物粪便不属于生物质能 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 金刚石、C60、纳米碳管都是碳的同素异形体,都属于原子晶体,金刚石、石墨碳纳米管、C60均有很高的熔沸点. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com