
【题目】以苯酚为原料合成 ![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
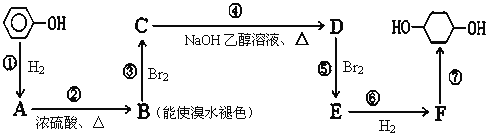
(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
【答案】(1)分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为![]() ;
;
(2)![]() ;
;![]() ;
;
(3)![]() ;
;
(4)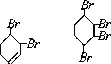 .
.
【解析】
试题分析:苯酚与氢气发生加成反应生成A,则A为![]() ;A在浓硫酸加热的条件下发生消去反应生成B,且B能使溴水褪色,证明B中含有碳碳双键,则B为
;A在浓硫酸加热的条件下发生消去反应生成B,且B能使溴水褪色,证明B中含有碳碳双键,则B为![]() ;B与溴发生加成反应生成C,则C为
;B与溴发生加成反应生成C,则C为![]() ;C与NaOH的乙醇溶液在加热条件下发生消去反应生成D,则D为
;C与NaOH的乙醇溶液在加热条件下发生消去反应生成D,则D为![]() ;D与溴可以发生1,2加成,也可以发生1,4加成,或全部发生加成反应生成四溴产物,由
;D与溴可以发生1,2加成,也可以发生1,4加成,或全部发生加成反应生成四溴产物,由![]() 可知,E应为1,4加成的产物,因此E为
可知,E应为1,4加成的产物,因此E为![]() ,E与氢气发生加成反应生成F,则F为
,E与氢气发生加成反应生成F,则F为![]() ,F最后水解可以生成
,F最后水解可以生成![]() 。
。
(1)由以上的分析可知,A为![]() ,鉴别A与苯酚利用的原理是苯酚能够与浓溴水反应生成白色沉淀,而A不能,因此鉴别苯酚与A的方法是:分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为
,鉴别A与苯酚利用的原理是苯酚能够与浓溴水反应生成白色沉淀,而A不能,因此鉴别苯酚与A的方法是:分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为![]() ;
;
(2)由上面的分析可知,B的结构简式为:![]() ;F的结构简式为:
;F的结构简式为:![]() ;
;
(3)反应④是![]() 与NaOH的乙醇溶液在加热条件下发生消去反应生成
与NaOH的乙醇溶液在加热条件下发生消去反应生成![]() ,因此方程式为:
,因此方程式为:![]() ;
;
(4)反应⑤是![]() 发生1,4加成生成
发生1,4加成生成![]() ,副反应是
,副反应是![]() 发生1,2加成和完全加成生成四溴产物,因此副产物有两种,结构简式为:
发生1,2加成和完全加成生成四溴产物,因此副产物有两种,结构简式为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在废水处理领域中,H2S 或 Na2S 能使某些金属离子生成极难溶的硫化物而除去。25℃, 某溶液含 0.02 molL-1Mn2+、0.1 molL-1 H2S,向该溶液中通入 HCl 气体或加入 NaOH 固体以 调节溶液 pH,(忽略溶液体积的变化、H2S 的挥发)。当溶液的 pH=5 时,Mn2+开始沉淀为 MnS,则 MnS 的溶度积为( )(已知:H2S 两级电离常数分别为 Ka1=1.3×10-7,Ka2=7.0×10-15)
A. 1.3×10-7 B. 7.0×10-15
C. 9.1×10-14 D. 1.82×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有 ( )
①蛋白质的变性 ②蛋白质的盐析
③胶体聚沉 ④盐类水解
⑤焰色反应 ⑥氧化还原反应
A.①②③④
B.①③④⑥
C.②③④⑤
D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年,科学家首次从人尿中分离出具有生长素效应的化学物质——吲哚乙酸,吲哚乙酸的结构如图所示。下列有关吲哚乙酸的说法中正确的是
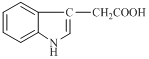
A.吲哚乙酸与苯丙氨酸互为同分异构体
B.吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应
C.1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2
D.吲哚乙酸苯环上的二氯代物共有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10 L,其中可能含K+、Ba2+、Na+、![]() 、Cl、
、Cl、![]() 、
、![]() 、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
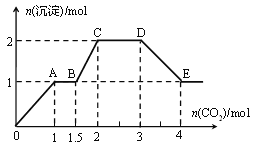
下列说法正确的是
A.该溶液中能确定存在的离子是Ba2+、![]() 、
、![]()
B.肯定不存在的离子是![]() 、OH
、OH
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2 mol·L1
D.OA 段反应的离子方程式:2![]() +CO2+3H2O===2Al(OH)3↓+
+CO2+3H2O===2Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子反应方程式正确的是:( )
A. 过量的二氧化碳通入NaOH溶液中:CO2+OH-==HCO3-
B. 氯气通入水中:Cl2+H2O==Cl-+ClO- +2H+
C. 硫酸亚铁溶液加入过氧化氢溶液Fe2++2H2O2+4H+==Fe3++4H2O
D. 向AlCl3溶液中过量的氨水:Al3+十4NH3·H2O==AlO2-十4NH4+十2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
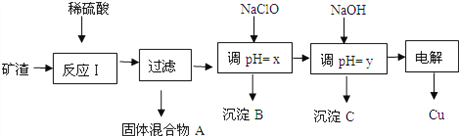
已知:Cu2O+2H+=Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______________.
(2)反应Ⅰ完成后,铁元素的存在形式为_____________.(填离子符号)请写出生成该离子的离子方程式_________________________.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________。
(4)书写出由沉淀C制备铝的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
(1) H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ/mol;
(2) 2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ/mol;
(3) H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ/mol;
(4) 2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
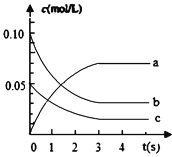
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com