
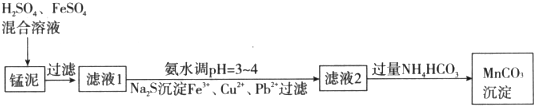
分析 H2SO4、FeSO4混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去未反应掉的二氧化锰和不溶的杂质,向滤液中氨水来调节溶液的PH值,并用硫化钠来沉淀铜离子和铅离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰,
(1)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原;
(2)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝;
②生产时H2SO4、FeSO4混合溶液中$\frac{c({H}^{+})}{c(F{e}^{2+})}$控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;若$\frac{c({H}^{+})}{c(F{e}^{2+})}$>1,调节$\frac{c({H}^{+})}{c(F{e}^{2+})}$到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;
(3)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水;
(4)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式MnO2~~MnCO3,进行算计.
解答 解:(1)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原,所以方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝,故答案为:取少量滤液1,加入铁氰化钾溶液,若无蓝色沉淀生成,证明Fe2+被氧化完全;
②生产时H2SO4、FeSO4混合溶液中$\frac{c({H}^{+})}{c(F{e}^{2+})}$控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;若$\frac{c({H}^{+})}{c(F{e}^{2+})}$>1,调节$\frac{c({H}^{+})}{c(F{e}^{2+})}$到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;故答案为:$\frac{c({H}^{+})}{c(F{e}^{2+})}$过大,在调节pH环节会多消耗氨水;向混合溶液中加适量铁粉;
(3)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水,所以离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(4)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式
MnO2~~~~~~~~MnCO3,
87 115
1740kg×18%×95% m
$\frac{87}{1740kg×18%×95%}=\frac{115}{m}$,
解之得m=393.3kg,故答案为:393.3.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写化学反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜是负极 | |
| C. | 铜铁原电池工作时,若有2.8 g铁被溶解,电路中就有0.15mol电子通过 | |
| D. | 由镁、铝作电极与NaOH溶液构成的原电池中铝是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 | |
| B. | 锡在常温下以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 灰锡和白锡的相互转化互为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、Br-、SCN- | B. | NH4+、Na+、CO32-、OH- | ||
| C. | K+、Na+、PO43-NO3- | D. | Al3+、Mg2+、SO42-HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
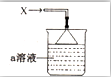 如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )| A. | 气体X易液化的原因是相对分子质量较大 | |
| B. | W溶液四种离子中两两结合所能形成的离子化合物有两种 | |
| C. | 若a溶液吸收一定量的气体X后,溶液pH=7,此时溶液中有4种溶质 | |
| D. | a溶液中由水电离出的c(H+)=10-13mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 软脂酸和油酸互为同系物 | |
| C. | 聚乙烯能使溴水褪色 | |
| D. |  分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中溶液褪色,加热褪色后的溶液,溶液又恢复原色 | 该气体为SO2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com