
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
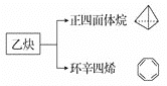
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒的ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其工作原理如图所示。下列说法错误的是( )
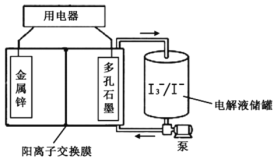
A.放电时,Zn2+通过离子交换膜移向右侧
B.放电时,电解液储罐中I![]() 与I-的物质的量之比逐渐增大
与I-的物质的量之比逐渐增大
C.充电时,多孔石墨电极接外电源的负极
D.通过更换金属锌和补充电解液储罐中的电解液可实现快速“充电”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B. 铜片与浓HNO3:Cu+NO3-+4H+===Cu2++NO↑+2H2O
C. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-![]() NH3·H2O
NH3·H2O
D. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,一定含有![]()
B.观察钾元素焰色反应的操作是:将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有![]()
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
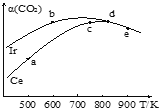
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航空航天领域。硼化钒(VB2)—空气电池的放电反应为4VB2+11O2=4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示,下列说法正确的是( )
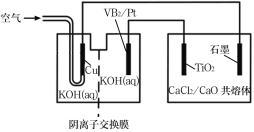
A.电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B.Pt极反应式为2VB2+22OH--22e-=V2O5+2B2O3+11H2O
C.电解过程中,铜极附近电解质溶液的pH增大
D.若石墨电极上只收集到4.48L气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以CaCO3为原料,制备CO2并获得CaCl2﹒6H2O晶体。下列图示装置和原理不能达到实验目的的是
A.制备CO2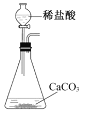
B.收集CO2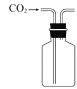
C.滤去CaCO3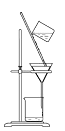
D.制得CaCl2﹒6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
![]()
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[![]() ,
,![]() ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com