
对H2O的电离平衡不产生影响的粒子是( )
A.H
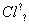
 B.26M3+ C.
B.26M3+ C.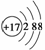 D.
D. 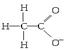
科目:高中化学 来源: 题型:
(1)写出下列化合物的名称或结构简式:

(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如下:
①麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
②下列各物质:
 与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)  CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
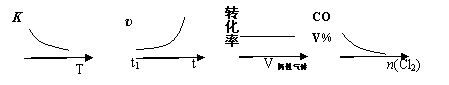
① ② ③ ④
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g) HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
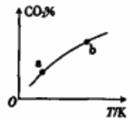
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
把1 mL 0.1 mol·L-1的H2SO4加水稀释制成2 L溶液,在此溶液中由水电离产生的H+的浓度接近于( )
A.1×10-4 mol·L-1 B.1×10-8 mol·L-1
C.1×10-11 mol·L-1 D.1×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
有关麦芽糖的下列叙述中,错误的是( )
①纯净的麦芽糖是无色晶体,易溶于水,有甜味 ②麦芽糖能发生银镜反应,是一种还原性糖 ③1 mol麦芽糖发生水解得到1 mol葡萄糖和1 mol果糖 ④麦芽糖和蔗糖水解的产物完全相同
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质。请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是________;C、N、O、F的第一电离能由大到小的顺序是________。
(2)A、B均为短周期金属元素。依据表中的数据,写出B原子的电子排布式:________。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+________颜色(填“无”或“有”)。
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是________(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com