
| 3 |
| 2 |
| 3 |
| 2 |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
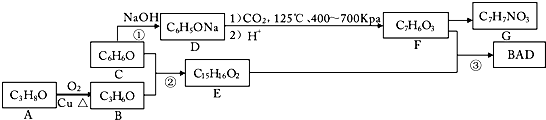
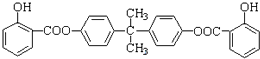
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B、将水加热,Kw增大,pH减小 |
| C、向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 |
| D、向水中加入少量Na2SO4固体,平衡不移动,c(H+)一定为10-7 mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作或事实 | 实验目的或结论 | ||||
| A | 淡黄色试液
| 说明原溶液中一定含有FeCl3 | ||||
| B | Br2
| 制备少量溶液 | ||||
| C | 无色试液
| 说明原溶液中一定不含钾元素 | ||||
| D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA |
| B、标况下,22.4L SO3含有NA个SO3分子 |
| C、78g Na2O2与足量水充分反应时电子转移数为2NA |
| D、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③⑥ |
| C、②⑥ | D、④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com