
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
分析 氨碱法制纯碱,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料,先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液.其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品.2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用.含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用.CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.氯化钠的利用率低.
联合制碱法,以氨气、水、二氧化碳、氯化钠为原料.氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为在该温度下它的溶解度较小.最后一步,加热析出的碳酸氢钠得到纯碱,原理(方程式)为:
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2这一工序.
解答 解:A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;
B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;
C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;
D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D错误;
故选B.
点评 本题考查了两种纯碱的工业制法,氨碱法和联合制碱法,考生要对两种方法的原理熟练掌握,尤其注意掌握其中区别.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
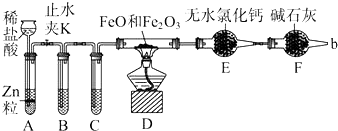
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
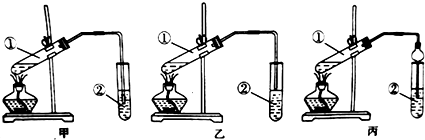
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
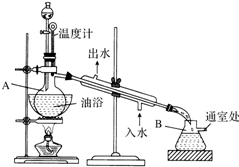 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
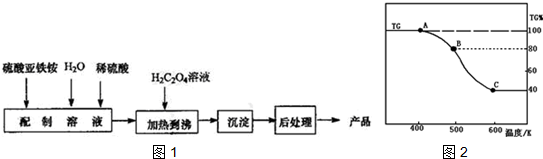
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
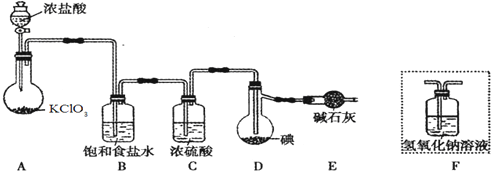
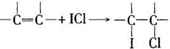
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com