
分析 (1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体;
(3)过量的Na2CO3是为了除去Ca2+、Ba2+杂质离子,反应生成碳酸钡、碳素钙沉淀;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7.
解答 解:(1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl,故答案为:Ba(OH)2、Na2CO3、稀HCl;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体,故答案为:过滤、蒸发结晶;
(3)过量的Na2CO3是为了除去Ca2+、Ba2+杂质离子,方程式为Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7,故答案为:用PH试纸测试溶液的pH呈中性.
点评 本题考查学生对粗盐提纯的基本方法,掌握分离提纯我的基本方法和操作,属于中等难度试题.


科目:高中化学 来源: 题型:选择题
| A. | 质子与电子之间 | B. | 水分子与水分子之间 | ||
| C. | 氧分子中氧原子与氧原子之间 | D. | 氯化钠中钠离子与钠离子之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96g | B. | 74g | C. | 82.5g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 a L | B. | a L | C. | 2 a L | D. | 3 a L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
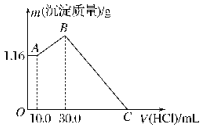 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 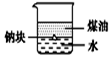 用图装置证明ρ(煤油)<ρ(钠)<ρ(水) | B. | 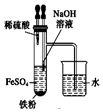 用图装置制备Fe(OH)2 | ||
| C. | 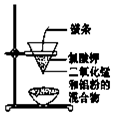 用图装置制取金属锰 | D. | 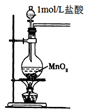 用图装置制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
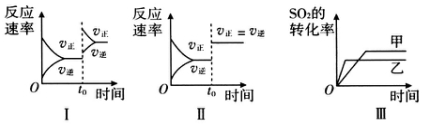
| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com