
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.分析 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体,则XY2是NO2,所以X为N元素,Y为O元素;Z基态原子的M层与K层电子数相等,则K、M层均有2个电子,则Z为Mg元素;R2+的3d轨道有9个电子,则R为外围电子排布为3d104s1,则R为29号元素Cu;
(1)Y为O元素,其原子核外有8个电子,分两层排布;
(2)Mg在第三周期,同周期从左到右第一电离能逐渐增大,第IIA与第IIIA族,第VA与第VIA族反常;
(3)根据NO2-中N原子的价层电子对数判断;
(4)利用均摊法计算;
(5)铜离子与氨水结合形成铜氨配离子;根据离子中配位键和H-N的数目计算.
解答 解:X、Y、Z、R为前四周期元素,且原子序数依次增大,XY2是红棕色气体,应是NO2,则X为N元素、Y为O元素;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等,则M层电子数为2,故Z为Mg;R2+离子的3d轨道中有9个电子,R原子核外电子数=2+8+8+9+2=29,则R为Cu元素,
(1)Y为O元素,基态原子的电子排布式是1s22s22p4;
故答案为:1s22s22p4;Cl;
(2)Z为Mg元素,所在周期中第一电离能最大的主族元素是Cl元素;
故答案为:Cl;
(3)NO2-离子中心N原子孤电子对=$\frac{5+1-2×2}{2}$=1,价层电子对数=2+1=3,故NO2-离子的立体构型是V形;
故答案为:V形;
(4)晶胞中阳离子处于体心与顶点,晶胞中阳离子数目=1+8×$\frac{1}{8}$=2,阴离子处于处于体内及面上,晶胞中阴离子数目=2+4×$\frac{1}{2}$=4,故晶胞中阴离子与阳离子的个数比是4:2=2:1,
故答案为:2:1;
(5)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,说明得到四氨合铜络离子,还应生成氢氧根离子与水,该反应的离子方程式是2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;[Cu(NH3)4]2+中含有4个配位键和12个N-H,共16个σ键,则1mol[R(NH3)4]2+中含有的σ键的数目是16NA;
故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;16NA.
点评 本题考查位置结构性质相互关系及应用,涉及电子排布式、杂化类型的判断、第一电离能、晶胞计算、分子空间构型判断等知识点,这些都是高考高频点,明确物质性质、价层电子对互斥理论、均摊法等知识点即可解答,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
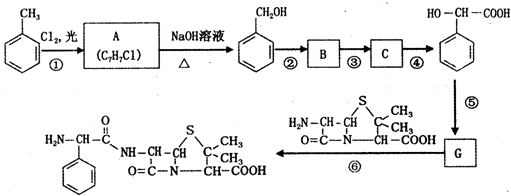

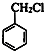 ,C
,C .
.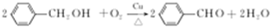 .
.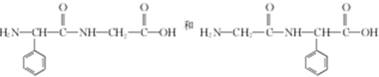 .
. 含苯环的所有同分异构体的结构简式:
含苯环的所有同分异构体的结构简式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
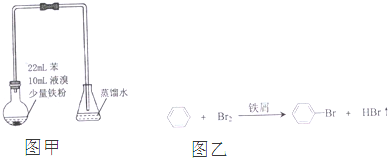
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为2CO2+O2+4e-═2CO32- | |
| B. | CO32-向正极移动 | |
| C. | 电子由正极经外电路流向负极 | |
| D. | 电池中CO32-的物质的量将逐渐减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com