
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化成金刚石的反应是吸热反应 | |
| C. | △H3=△H1-△H2 | |
| D. | △H1>△H2 |
分析 由题给信息可知C(石墨,s)═C(金刚石,s)△H3=△H2-△H1=+1.9kJ•mol-1,说明△H2>△H1,且石墨能量比金刚石低,石墨较稳定,以此解答该题.
解答 解:A.石墨能量较低,较为稳定,故A错误;
B.由C(石墨,s)═C(金刚石,s)△H3=+1.9kJ•mol-1可知石墨转化成金刚石的反应是吸热反应,故B正确;
C.由盖斯定律可知△H3=△H2-△H1,故C错误;
D.△H3=△H2-△H1=+1.9kJ•mol-1,说明△H2>△H1,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,题目着重考查利用盖斯定律书写热化学方程式、物质的能量越低越稳定,题目难度不大,注意物质的稳定性与能量的关系.


科目:高中化学 来源: 题型:解答题
 NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
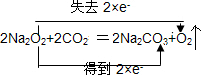 .
.
| 实验学生 | 实验操作 | 现象与结论 |
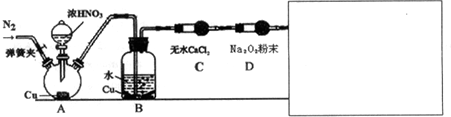
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$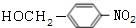 +NaCl.
+NaCl.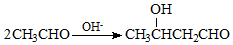 .
.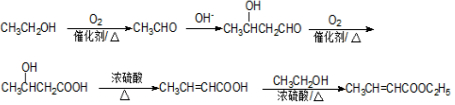 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在燃煤中添加石灰石以减少酸雨的发生 | |
| B. | 严格执行机动车尾气排放标准 | |
| C. | 将所有垃圾通过露天焚烧、深埋的方式进行处理 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯可降解塑料代替聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
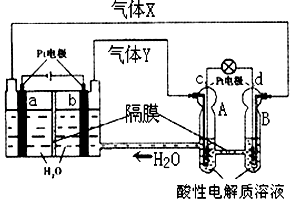 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | c极上进行还原反应,B中的H+可以通过隔膜进入A | |
| B. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| C. | 该装置开始工作后,右端装置能量变化为:电能→化学能 | |
| D. | 当有0.2mol电子转移时,a极产生1.12L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物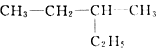 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| B. | 2-甲基丁烷和2,2-二甲基丙烷互为同系物 | |
| C. | 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色 | |
| D. | 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com