
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
分析 相同温度下,酸的电离常数越大,该酸的酸性越强,强酸能和弱酸的盐反应生成弱酸,根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF、NaNO2+HF→HNO2+NaF知,酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),据此分析解答.
解答 解:相同温度下,酸的电离常数越大,该酸的酸性越强,强酸能和弱酸的盐反应生成弱酸,根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF、NaNO2+HF→HNO2+NaF知,酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),
A.通过以上分析知,K(HF)最大为7.2×10-4,故A正确;
B.根据以上分析知,K(HNO2)处于中间状态,为4.6×10-4,故B错误;
C.根据NaCN+HNO2→HCN+NaNO2、NaCN+HF→HCN+NaF即可得出酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),即根据其中两个反应即可得出三种酸对应的电离常数,故C正确;
D.通过以上分析知,酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),故D正确;
故选B.
点评 本题考查了弱电解质的电离,明确酸的强弱及其电离平衡常数的关系是解本题关键,结合强酸制取弱酸来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
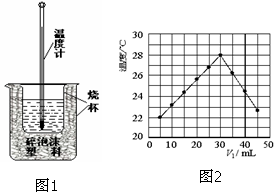 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
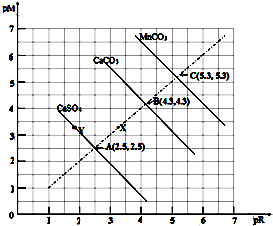
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com