
| A | B | C | D |
 | 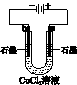 |  |  |
| 盐桥中的Cl-移向ZnSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为: Cu2++2e-=Cu | 正极反应式为: O2+4e-+2H2O=4OH- |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N | B、M | C、X | D、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
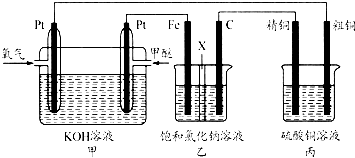
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA | ||||
| B、室温下,pH=13的NaOH溶液中,OH-离子的数目为0.1 NA | ||||
| C、1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | ||||
D、5NH4NO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl═Na++Cl- |
| B、NaCl溶液中存在自由移动的水合钠离子、水合氯离子 |
| C、该过程中,水分子的作用是氯化钠溶液能够导电的重要原因 |
| D、氯化钠固体中不存在钠离子、氯离子,所以氯化钠固体不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
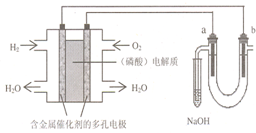 用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,负极反应式为:H2+2 OH--2e-=2H2O |
| B、电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.32g O2时,b 极周围会产生0.04g H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com