
痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl;②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
科目:高中化学 来源: 题型:
自2009年1月1日开始,我国起征燃油税。减少汽油等成品油的使用是这次税费改革的目的之一。下列说法不正确的是( )
A.工业上将石油蒸馏得到汽油,发生了化学变化
B.汽车尾气中的碳氢化合物会加剧温室效应
C.汽车尾气的大量排放是形成光化学烟雾的重要原因
D.汽车尾气中的“黑烟”会增加空气中固体颗粒的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L容积不变的容器中,发生N2+3H2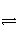
 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是( )
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是( )
A.1.6 mol B.2.8 mol C.3.2 mol D.3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应方程式中有一个与其他三个在分类上不同,这个反应是( )
A.S+O2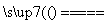 SO2 B.Na2CO3+CO2+H2O===2NaHCO3
SO2 B.Na2CO3+CO2+H2O===2NaHCO3
C.NH4HCO3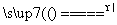 NH3↑+CO2↑+H2O D.CO2+C
NH3↑+CO2↑+H2O D.CO2+C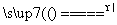 2CO
2CO
查看答案和解析>>
科目:高中化学 来源: 题型:
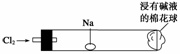
“绿色化学实验”进课堂,某化学老师为“氯气与金属钠反应”设计了如右图所示装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉花球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是 ( )。
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于
Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
一些烷烃的标准燃烧热如下表:
| 化合物 | 标准燃烧热(△H/kJ·mol-1) | 化合物 | 标准燃烧热(△H/kJ·mol-1) |
| 甲烷 | -891.0 | 正丁烷 | -2878.0 |
| 乙烷 | -1560.8 | 异丁烷 | -2869.6 |
| 丙烷 | -2221.5 | 异戊烷 | -3531.3 |
下列说法正确的是
A.热稳定性:正丁烷>异丁烷
B.正戊烷的标准燃烧热大约是△H=-3540kJ·mol-1
C.乙烷燃烧的热化学方程式为
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) △H=-1560.8kJ·mol-1
D.在101kPa下,甲烷的热值是891.0kJ·g-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com