
| A. | 减少部分NH4HS固体 | B. | 压强温度不变充入少量Ar | ||
| C. | 容积、温度一定、充入He | D. | 增加部分NH4HS固体 |
分析 A、硫氢化铵是固体,其量的增减不影响化学平衡;
B、压强温度一定,充入少量氩气,体积增大,氨气和硫化氢气体的分压减小;
C、充入稀有气体,各组分浓度没有变化,化学平衡不移动;
D、硫氢化铵是固体,其量的增减不影响化学平衡.
解答 解:A、由于硫氢化铵是固体,其量的增减不影响化学平衡移动,故A错误;
B、压强温度一定,充入少量氩气,体积增大,氨气和硫化氢气体的分压减小,平衡正向进行,故B正确;
C、容积、温度一定,充入氦气,各组分的浓度没有发生变化,化学平衡不移动,故C错误;
D、由于硫氢化铵是固体,其量的增减不影响化学平衡移动,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,注意恒容、恒温体积下充入稀有气体,化学平衡不移动,本题难度中等.


科目:高中化学 来源: 题型:实验题
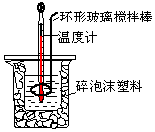 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 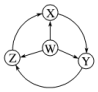 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
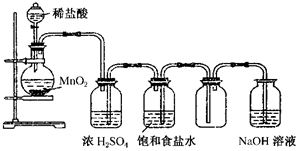 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
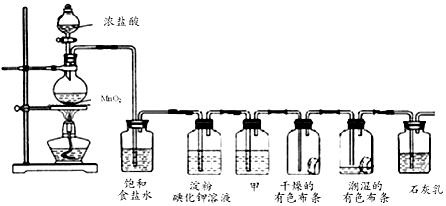
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤中加入CaO后可减少酸雨的发生气体的排放 | |
| B. | 纤维素、蛋白质、油脂都是天然有机高分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
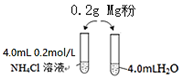 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
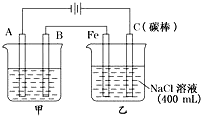 如图为相互串联的甲乙两电解池,试回答:
如图为相互串联的甲乙两电解池,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com