
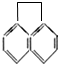
 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 7种 |
科目:高中化学 来源: 题型:选择题
| A. | HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱 | |
| B. | Cl-、Na+、Mg2+、F-的半径依次减小 | |
| C. | Na、Mg、Al失电子能力随最外层电子的增加而增强 | |
| D. | HI、HBr、HCl、HF的沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
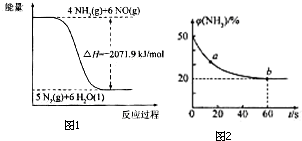 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
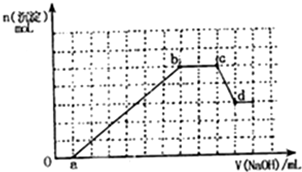 某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.
某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
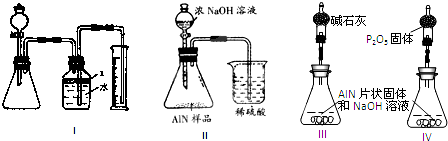
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
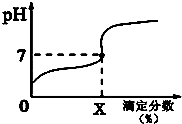 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小 | |
| B. | HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$(x为滴定分数) | |
| C. | 当滴定分数为100时,溶液中水的电离程度最大 | |
| D. | 滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com