
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
【答案】1 50% < ACD 充入空气,NO转化为NO2,有利于提高原料利用率 CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol
【解析】
(1)①利用三段式计算出平衡时各物质的量的平衡浓度,代入平衡常数表达式计算.
②保持温度不变,平衡常数不变.向上述平衡体系中再加入0.1molCO,可以等效为开始加入0.3molCO,0.3molH2O;令参加反应的水的物质的量为xmol,利用三段式用x表示出各物质的浓度变化量、平衡时各物质的平衡浓度,代入平衡常数计算x值,再利用转化率定义计算;
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小;
(3)A.由图可知c点n(NH3)和n(H2)相等;
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行;
C.平衡常数只受温度影响,温度相同,平衡常数相同;
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行;
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率;
(5)根据盖斯定律利用热化学方程式加减构造目标热化学方程式。
(1)①对于可逆反应: CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.2 0.3 0 0
转化物质的量浓度(mol/L)0.12 0.12 0.12 0.12
平衡物质的量浓度(mol/L)0.08 0.18 0.12 0.12
所以该温度下此反应的平衡常数K=![]() =1;
=1;
②保持温度不变,平衡常数不变,向上述平衡体系中再加入0.1molCO,可以等效为开始加入0.3molCO,0.3molH2O;
对于可逆反应: CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.3 0.3 0 0
转化物质的量浓度(mol/L)x x x x
平衡物质的量浓度(mol/L)0.3-x 0.3-x x x
所以![]() =1,解得x=1.5,
=1,解得x=1.5,
所以当反应重新建立平衡时,水蒸气的总转化率α(H2O)=![]() ×100%=50%;
×100%=50%;
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小.由表中数据可知:T1 时平衡常数大于573K时平衡常数,故T1<573K;
(3)A.由图可知c点n(NH3)和n(H2)相等,故A正确;
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点表示NH3生成速率大于NH3分解速率,故B错误;
C.温度相同,平衡常数相同,e点和d点时反应的平衡常数相同,故C正确;
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点时正反应速率大于逆反应速率,故D正确;
故答案为ACD;
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率;
(5)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJmol-1,由盖斯定律可知:①+②得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-1734kJ/mol;即CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol。


科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入CuCl2溶液中
②向饱和Na2CO3溶液中通入足量CO2
③少量Ca(OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中滴入少量盐酸
⑤过量NaOH溶液和明矾溶液混合
A.只有①③④⑤B.只有①④C.只有②③D.只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
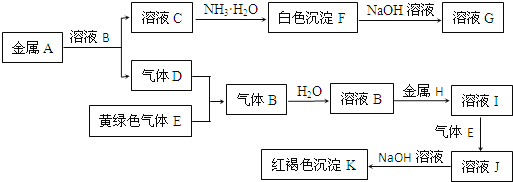
(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知室温下BaSO4的Ksp =1.1×1010,欲使溶液中c(SO42-)≤1.0×106 mol·L1,应保持溶液中c(Ba2+)≥___________。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是_____________。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) c(OH-) +c(CH3COOH)= 0.1mol·L1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
(2)如图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v=

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应![]() >
>![]() ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
B. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2)=5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫代磷酸锌( ![]() )是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
)是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
(1)二硫代磷酸锌结构中,P的杂化方式为__________________,C1、P、S的第一电离能由大到小的顺序为_____________________。
(2)Zn2+的价层电子排布式为________________,锌能够跟强碱溶液反应生成[Zn(OH)4]2-,不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为__________________。
(3)硫元素能形成多种含氧酸,两分子硫酸脱去一分子水生成焦硫酸(H2S2O7),则1mol焦硫酸中含有硫氧键的数目为____________;用价层电子互斥理论判断并解释SO32-与SO42-键角的相对大小。
(4)纤锌矿的六方晶体结构如图所示,该晶胞的化学式为___________,其晶胞参数分别为a pm和b pm,则该晶体的密度为____________________g·cm-3(用含a、b、NA的代数式表示)。
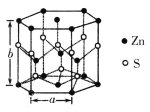
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
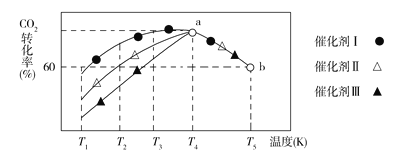
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________。
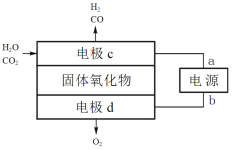
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为________、_____。
②阴阳两极生成的气体的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com