
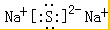 ;A、C、D三种元素组成的化合物为NaOH,含有化学键的类型是离子键、共价键;
;A、C、D三种元素组成的化合物为NaOH,含有化学键的类型是离子键、共价键;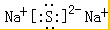 ;离子键、共价键;
;离子键、共价键; H2+CO2,在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molH2O和1molCO,2molH2O和2molCO,二者为等效平衡,
H2+CO2,在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molH2O和1molCO,2molH2O和2molCO,二者为等效平衡,

科目:高中化学 来源: 题型:
 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A、b极上发生的电极反应是:4H2O+4e-═2H2↑+4OH- |
| B、d极上发生的电极反应是:O2+4H++4e-═2H2O |
| C、c极上进行还原反应,B中的H+可通过隔膜进入A |
| D、当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 )的废水可以利用微生物电池除去,其原理如图所示( )
)的废水可以利用微生物电池除去,其原理如图所示( )
| A、B极是正极 |
| B、B极是阳极 |
| C、每转移2mol电子,有1molCH3COO-被氧化 |
D、A极电极反应式为: +2e-+H+ +2e-+H+ +Cl- +Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2溶液(CuCl2) |
| B、CuSO4溶液(CuO) |
| C、NaCl溶液(HCl) |
| D、KNO3溶液(KNO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com