

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
分析 A.根据图象知,当盐酸中滴加氢氧化钠溶液时,溶液的PH=1,则c(HCl)=0.1mol/L,配制100 mL该溶液可用图3装置进行;
B.氯化氢和氢氧化钠都是强电解质,且盐酸和氢氧化钠元数相同,当恰好中和时,二者的物质的量相等;
C.根据pH变化曲线知,a是氢氧化钠溶液滴定盐酸溶液,b是盐酸滴定氢氧化钠溶液;
D.用待测液润洗锥形瓶,导致待测液的物质的量增大.
解答 解:A.配制100 mL溶液,可选择100 mL容量瓶,离刻度线1-2cm用胶头滴管进行定容,但根据曲线可以看出盐酸溶液的pH=1,pH=-lgC(H+)=1,所以C(HCl)=C(H+)=0.1mol/L,故A错误;
B.P点时二者恰好完全中和,盐酸是一元强酸,氢氧化钠是一元强碱,当二者恰好中和时,二者反应生成氯化钠,则溶液呈中性,故B正确;
C.根据图象知,当a曲线发生中和反应时,溶液的pH=1,说明原溶液是盐酸,所以a曲线是氢氧化钠滴定盐酸的实验,滴定可在图2的装置中进行,故C正确;
D.若用待测液润洗锥形瓶,会导致待测液中溶质的物质的量增大,滴定时消耗的标准液体积偏大,测定结果偏高,故D正确;
故选A.
点评 本题考查了酸碱中和滴定实验,根据图中pH变化曲线确定滴定顺序,结合酸碱的性质分析解答,难点是滴定曲线对应的意义判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
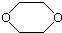 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
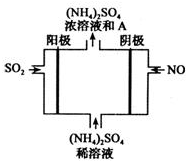 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
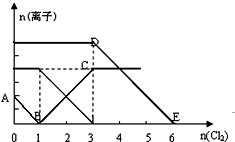 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
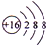
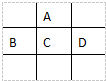 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com