


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、气态氢化物稳定性最强的是HZ |
| B、原子半径由小到大的顺序为W<M<Y |
| C、室温下,可用Y的容器盛装稀硝酸 |
| D、X的单质可通过电解XZ的水溶液获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W的最高价氧化物能与水反应生成相应的酸 |
| B、Y、Z元素的单质作电极,在NaOH溶液下构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、98 | B、116 |
| C、158 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
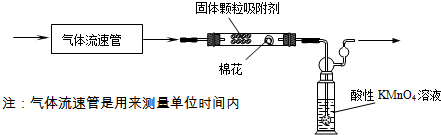
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①溶液中加入适量四氯化碳 | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com