
| A、在NaAlO2溶液中加入过量盐酸溶液 |
| B、在AlCl3溶液中加入过量氨水 |
| C、在AlCl3溶液中加入过量NaOH溶液 |
| D、用Al2O3与水反应 |


科目:高中化学 来源: 题型:
| A、0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、2.8gN2和2.24 LCO组成的混合物中质子数为1.4 NA |
| C、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| D、25℃时,1LpH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入盐酸,先产生沉淀,然后沉淀又溶解 |
| B、都能透过半透膜 |
| C、都有丁达尔现象 |
| D、都是均一的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
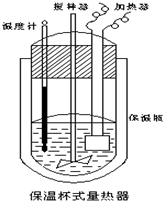 在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.
在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.查看答案和解析>>
科目:高中化学 来源: 题型:
 向Al2 (SO4)3逐滴加入NaOH溶液得到沉淀如图
向Al2 (SO4)3逐滴加入NaOH溶液得到沉淀如图查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 第一份中加AgNO3溶液 | 有白色沉淀生成 |
| ② | 第二份中加足量NaOH溶液并加热 | 只收集到标准状况下0.896L气体,无沉淀生成,同时得到溶液A |
| ③ | 向溶液A中通入过量CO2,所得白色沉淀经过滤、洗涤、灼烧后称量 | 固体质量为2.04g |
| ④ | 第三份加足量BaCl2溶液,所得沉淀经足量稀盐酸洗涤、干燥后称量 | 沉淀质量为23.3g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:
如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A、Al2H6中Al为-3价,H为+l价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6是共价化合物 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com