
分析 (1)MgCl2是强酸弱碱盐,镁离子水解导致溶液呈酸性,温度不变,水的离子积常数不变;
(2)①任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),但水解程度很小;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒判断c(H+)、c(OH-)相对大小;
(3)A.根据溶液中氢氧根离子的浓度计算,氢氧根离子浓度越大,则氢离子浓度越小;
B.强酸与强碱恰好反应溶液为中性;
C.CH3COOH与NaOH恰好反应生成CH3COONa,溶液显碱性;
D.硫酸与氢氧化钡反应生成硫酸钡沉淀;
(4)①A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题.
②根据溶液酸碱性与溶液pH的表达式计算出pHb、pHc,然后根据水的离子积计算出pHb+pHc.
解答 解:(1)MgCl2是强酸弱碱盐,镁离子水解导致溶液呈酸性,从而促进水的电离;温度不变,水的离子积常数不变,
故答案为:促进;不变;
(2)①任何电解质溶液中都存在电荷守恒,如果c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故B错误,故选B,
故答案为:B;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),但水解程度很小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故选A,
故答案为:A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,
故答案为:中性.
(3)A.溶液中氢氧根离子浓度越大,则氢离子浓度越小,40mL0.1mol/L NaOH溶液中c(OH-)=0.1mol/L,20mL0.1mol/L Ba(OH)2溶液中c(OH-)=0.2mol/L,则 Ba(OH)2溶液中氢氧根离子浓度越大,氢离子浓度越小;
故答案为:⑤;
B.强酸与强碱恰好反应溶液为中性,①和④,①和⑤;③和④;③和⑤均能恰好反应生成强酸强碱盐,溶液显中性,则任取2份溶液混合,混合溶液的pH为7(或接近7),有4种取法;
故答案为:4;
C.40mL0.1mol/L CH3COOH溶液与40mL0.1mol/L NaOH溶液恰好反应生成CH3COONa,溶液显碱性,则pH大于7;
故答案为:大于;
D.硫酸与氢氧化钡反应生成硫酸钡白色沉淀,所以混合后出现白色溶液的两种溶液是①⑤;
故答案为:①⑤.
(4)①CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离;NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离;盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,则A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,则A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸;
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=-lg$\frac{1{0}^{-14}}{c(O{H}^{-})}$-lgc(H+)=-lg10-14=14,
故答案为:14.
点评 本题考查离子浓度大小比较、酸碱混合溶液的酸碱性判断、无机物的推断、溶液pH的简单计算、明确溶液中的溶质及其性质是解本题关键,根据溶液酸碱性确定其它离子浓度相对大小,侧重考查学生分析问题、解答问题能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
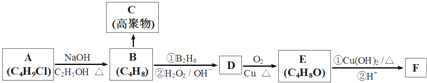
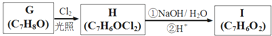
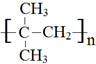 ,
,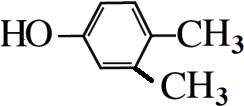 .
.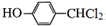 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaCl+2H2O.
+2NaCl+2H2O.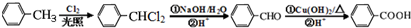 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ;
; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com