
| A. | 9mol•L-1 | B. | 6mol•L-1 | C. | 3mol•L-1 | D. | 2mol•L-1 |
分析 在合成氨反应中,将等物质的量的氮气和氢气充入一密闭容器中发生反应,测得 2min 内氨的平均反应速率为 2mol•L-1•min-1,则上层氨气的浓度=2mol•L-1•min-1×2min=4mol/L,2min 末 N2 的浓度为 7mol•L-1,结合化学平衡三行计算计算,起始量-变化量=某时刻量列式计算得到.
解答 解:将等物质的量的氮气和氢气充入一密闭容器中发生反应,测得 2min 内氨的平均反应速率为 2mol•L-1•min-1,则上层氨气的浓度=2mol•L-1•min-1×2min=4mol/L,则消耗氮气浓度为2mol/L,消耗氢气浓度为6mol/L,2min 末 N2 的浓度为 7mol•L-1,则氮气起始量浓度为9mol/L,列式得到
N2+3H2=2NH3
起始量(mol/L) 9 9 0
变化量(mol/L) 2 6 4
2min量(mol/L) 7 3 4
氢气的起始浓度9mol/L,
故选A.
点评 本题考查了化学反应速率、化学三行计算的理解应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
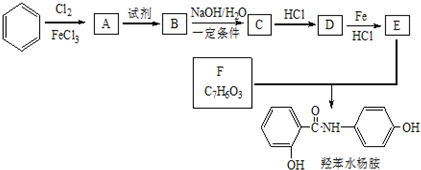
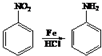
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$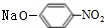 +NaCl+H2O.
+NaCl+H2O.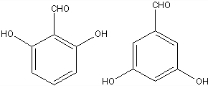 、
、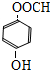 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备氯气是利用了二氧化锰的还原性 | |
| B. | 实验室制备氯气时使用过量的浓盐酸可使二氧化锰完全反应 | |
| C. | 用金属与氯气直接化合或金属与盐酸反应都可制得FeCl2 | |
| D. | 将Cl2与HCl混合气体通过四氯化碳可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2气体这入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HCLO | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液的pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向Ca(H2PO4)2溶液中滴入过量的NaOH溶液:3Ca2++6H2PO4-+12OH-═Ca3(PO4)2↓+12H2O+$4PO_{4}^{-}}$ | |
| D. | 112mL(S.T.P)Cl2通入10ml1mol/L的FeBr2溶液:2Fe2++4Br-+3CL2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子中子数与质子数之差为 19 | |
| B. | 他们获得了一种新元素 | |
| C. | ${\;}_{26}^{45}$Fe与${\;}_{26}^{56}$Fe的化学性质几乎完全相同 | |
| D. | 这种铁原子衰变出 2 个质子后变成${\;}_{26}^{43}$Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
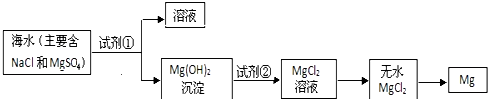
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | 容器内的压强不再随时间变化 | |
| C. | 单位时间内每消耗1molX,同时消耗3molY | |
| D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com