
【题目】A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5。
(1)C的原子结构示意图为 ,D在元素周期表中的位置 。
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为 ;A单质在E单质中燃烧生成化合物乙,乙的电子式为 。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为 。
(4)含B元素的化合物常用作净水剂,用文字和化学用语解释净水原因: 。
(5)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数递增, ,非金属性增强。
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
【答案】(1)![]() 第3周期,第VIA族
第3周期,第VIA族
(2)离子键、非极性共价键![]()
(3)Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
(4)Al3++3H2O![]() Al(OH)3+3H+Al3+水解产生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的。
Al(OH)3+3H+Al3+水解产生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的。
(5)原子半径递减,得电子能力增强
(6)2S2Cl2+2H2O =" 3S" +SO2+4HCl
【解析】试题分析:A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,E为氯元素,F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素。
(1)C为硅元素,C的原子结构示意图为![]() ,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族。
,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族。
(2)钠单质在氧气中燃烧生成化合物甲为过氧化钠,甲中所含化学键为离子键、非极性共价键;钠单质在氯气中燃烧生成化合物乙为氯化钠,氯化钠的电子式为![]() 。
。
(3)铝单质与氧化铁在高温条件下反应是冶炼铁的方法之一,该反应的化学方程式为Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(4)B是铝元素,含B元素的化合物常用作净水剂,因为Al3++3H2O![]() Al(OH)3+3H+,Al3+水解产生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的。
Al(OH)3+3H+,Al3+水解产生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的。
(5)氯元素的非金属性强于硫元素,用原子结构解释原因:同周期元素随着原子序数的递增,原子半径递减,得电子能力增强,非金属性增强。
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物为S2Cl2,该物质可与水反应生成一种能使品红溶液褪色的气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,则1molS2Cl2参加反应要转移1.5mol电子,其中只有一种元素化合价发生改变,则应为硫元素的化合价在改变,该反应的化学方程式为2S2Cl2+2H2O =" 3S" +SO2+4HCl。


科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A.反应①的平衡常数K1=[c(CO2)c(Cu)]/[c(CO)c(CuO)]
B.对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
C.反应③的平衡常数K=K1/K2
D.对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A.KCl
B.Na2S
C.Na2O
D.K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体,⑥为红棕色气体。
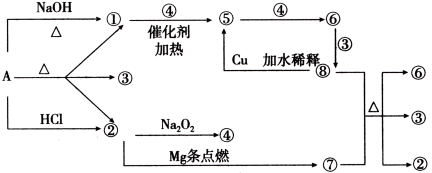
请完成下列各题:
(1)写出化学式A ,⑥ ,⑦ ;
(2)写出下列反应化学方程式:
⑧+⑦→②+③+⑥: ;①+④→⑤: ;
(3)⑧→⑤的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是

A.装置出口①处的物质是氯气
B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C.装置中发生的反应的离子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中SO2含量的增加会造成“酸雨”。下列活动会导致大气中SO2含量增加的是
A.燃烧煤炭中加入石灰石 B.利用风力、水力发电
C.硫酸工厂尾气回收处理 D.节假日燃放烟花爆竹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中:
(1)氧化剂是(填化学式) ,还原剂是(填化学式) 。
(2)在该反应中,若消耗了15.8g KMnO4,则转移了 mol 电子。
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法不正确的是
A.金属一般具有导电性、导热性、延展性
B.铁在潮湿的空气中不会生锈
C.铝表面有氧化物保护膜
D.金属钠保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_____________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1 molL﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 molL﹣1 NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_________molL﹣1(填数值)
(3)室温时,向100 mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com