
����Ŀ������ͬ�ݻ���4���ܱ����н���ͬһ�ֿ��淴Ӧ��2A(g)+B(g)![]() 3C(g)+2D(g)����ʼʱ4��������ʢA��B���������ʾ��������ʢ���ʵ�����
3C(g)+2D(g)����ʼʱ4��������ʢA��B���������ʾ��������ʢ���ʵ�����
���� | �� | �� | �� | �� |
A | 2mol | 1mol | 2mol | 1mol |
B | 1mol | 1mol | 2mol | 2mol |
����ͬ�¶��£�����ƽ��ʱ��4��������A��B��ת���ʵĴ�С��ϵ��
A.A��ת����Ϊ����<��<��<��B.A��ת����Ϊ����<��<��<��
C.B��ת����Ϊ����>��>��>��D.B��ת����Ϊ����>��>��>��
���𰸡�A
��������
����ʼʱ������������У�
2A(g)+B(g)![]() 3C(g)+2D(g)
3C(g)+2D(g)
�� 2 mol 1 mol
�� 1 mol 1 mol
�� 2 mol 2 mol
�� 1 mol 2 mol
AԽ��BԽ�࣬A��ת����Խ�ߣ���Aת������ߵ�Ϊ������͵�Ϊ�ף��������Ƚϣ����൱�����ҵĻ������ٷֱ�����1 mol A��1 mol B��Ӧ�Ǻ��²���ѹ��ƽ�������ƶ�ʹA��ת���ʼ�С����A��ת���ʶ����ң������ף�ͬ����B��ת���ʣ��ף��ң����������ʴ�ΪA��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ��ȵ������ǵ��͵����ǽ������ϣ��ֳư뵼����ϣ����ķ��ֺ�ʹ��������������һ�����������ֲ��Ͽ������з����Ʊ�������˵����ȷ����
![]()
A.��������ķ���ʽ��SiO2
B.����ٵĻ�ѧ����ʽ��SiO2 + C ![]() Si + CO2��
Si + CO2��
C.������У�ÿ����1mol Si��ת��4mol����
D.����������������ᷢ����Ӧ�����赥�ʲ���������ᷢ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�������ʴ�����������ʣ�ij������Ȥ�С��ѧ���ý���˿��������С��ͬ�������ֱ�̶�����ͼ��ʾ������װ���У��ٷ����ڲ��������ﱣ����ͬ��һ��ʱ�䣬���ж�ʵ�����ʱ�������������ȷ����

A.ʵ�����ʱ��װ�â�����Һ����½�
B.ʵ�����ʱ�����Һ��װ�â��װ�â�ĵ�
C.ʵ�����ʱ��װ�â��е�������ʴ������
D.ʵ�����ʱ��װ�â��е���������û����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����±���������ϵ��ͼ��ʾ����˵����ȷ����

A. ��֪HF��������ˮ���ȣ���HF����H1<0
B. ��ͬ�����£�HCl����H2��HBr��С
C. ��ͬ�����£�HCl����H3+��H4��HI�Ĵ�
D. һ�������£���̬ԭ������1molH-X���ų�akJ�����������������H2=+akJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��Ƽ��ձ����������ҹ���ѧ�����Ƴɹ�һϵ��ʯīϩ�����3d���ɽ�������(Mn��Fe��Co��Ni��Cu)��������������������H2O2Ϊ������ֱ�ӽ�CH4������C�ĺ����������ش��������⣺
��1����Fe��Co��Ni��Cu�У�ij��̬ԭ�Ӻ�������Ų���ѭ�����ع�����������ָ������ͬ��ԭ�ӹ����ȫ����������ȫ��״̬ʱ����ϵ��������ͣ�����ԭ�ӵ���Χ�����Ų�ʽΪ__��
��2���ڵ�����������Ԫ���У���̬ԭ��δ�ɶԵ���������Ԫ����__����Ԫ�ط��ţ���
��3�����������ȵ������¶����ή�ͣ���ԭ����__��
��4��ͭ����ɫ��Ӧ��___�����ִ���ѧ�У����������־�����Ǿ���ķ���Ϊ___��
��5��Mn��Co���۵�ϸߵ���___��ԭ��___��
��6���ܾ����Ͱ�ͭ(ͭ���Ͻ�)�����ֱ���ͼ1��2��ʾ��
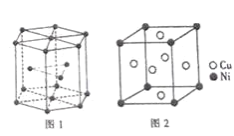
���ܾ����ѻ���ʽ������Ϊ__��
����֪��ͭ�������ܶ�Ϊdg��cm-3��NA���������ӵ�������ֵ��ͼ2����������������ͭԭ����̺˼��Ϊ__pm(�г�����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƽ���ҹ���ҵ��չ�о�����Ҫ���á���ijѧϰС����ʵ�������������з�Ӧװ��ģ������Ƽ�Ʊ� NaHCO3����Ӧԭ��Ϊ NH3+CO2+H2O+NaCl��NaHCO3��+NH4Cl������˵����ȷ����

A.װ�� a �пɸ���̼��Ʒ�ĩ��߷�Ӧ����
B.װ�� b��d ����ʢװ���� Na2CO3 ��Һ��ϡ����
C.װ�� c �к����ı���ʳ��ˮ����� CO2 ����Ч��
D.��Ӧ��װ�� c �е���ƿ�����ȴ�������ᾧ�õ� NaHCO3 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���С��ͬѧ����ͼ1װ�ý���ʵ�飬�Իش��������⡣
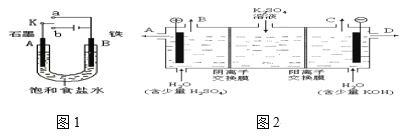
��1������ʼʱ����K��a���ӣ���A���ĵ缫��ӦʽΪ____��
��2������ʼʱ����K��b���ӣ���A���ĵ缫��ӦʽΪ____��
��3��������K��b����ʱ���������ʵ�飬����˵����ȷ����(�����)____��
A����Һ��Na+��A���ƶ�
B����A�����ݳ���������ʹʪ��KI������ֽ����
C����Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
��4����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼ2װ�õ���������Һ����ȡ������������������������ء�
���Ƶõ�����������Һ�ӳ���(�A������B������C������D��)___�������Ƶõ������ӳ���(�A������B������C������D��)___������
�ڴ�ʱͨ�������ӽ���Ĥ��������___(����ڡ�����С�ڡ����ڡ�)ͨ�������ӽ���Ĥ����������
��ͨ�翪ʼ������������ҺpH�����������ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ����ȷ����
A.̼�������Һ��������NaOH��Һ��Ϻ���ȣ�NH4����OH��![]() NH3����H2O
NH3����H2O
B.Ca(HCO3)2��Һ�еμ�����NaOH��Һ Ca2++HCO3-+OH-��CaCO3��+H2O
C.NaHSO4��Һ��Ba(OH)2��Һ��ַ�Ӧ����Һ�����ԣ�Ba2��+OH��+H��+SO42����BaSO4��+H2O
D.��Fe(OH)2�м���ϡ���3Fe2����4H����NO3-��3Fe3����NO����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol�����ƺ�bmol�������ĺϽ�Ͷ��mg����ˮ�У���ȫ�ܽ⣬����ʣ�࣬������Һ�ܶ�Ϊdgcm��3��������ؼ���ʽ���д�����ǣ�������
A.NaOH�����ʵ�������a��b��mol
B.NaAlO2�����ʵ���Ũ�ȣ�![]() mol/L
mol/L
C.���������H2�������![]() L
L
D.�μӷ�Ӧ��ˮ��������18��a+1.5b��g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com