
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
分析 氧化还原反应中含有元素化合价降低的物质为氧化剂,通过氧化反应得到的产物为氧化产物,根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性来解答.
解答 解:①2FeCl2+Cl2═2FeCl3,氧化剂为Cl2,氧化产物为FeCl3,所以氧化性Cl2>Fe3+;
②2FeCl3+2HI═I2+2FeCl2+2HCl,氧化剂为FeCl3,氧化产物为I2,所以氧化性Fe3+>I2;
③I2+Na2S═2NaI+S,氧化剂为I2,氧化产物为S,所以氧化性I2>S;
所以氧化性Cl2>Fe3+>I2>S,
故选A.
点评 本题考查了根据方程式来比较氧化性和还原性,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 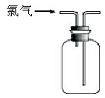 可用于氯气的收集 | B. | 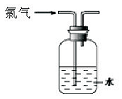 用于除去氯气中少量的氯化氢气体 | ||
| C. | 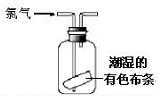 可证明氯气具有漂白性 | D. | 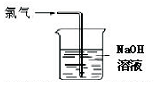 可用于实验室氯气的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工业中将氯气通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空气中久置失效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加硝酸后的不溶性沉淀一定是BaSO4 | |
| B. | Na2SO3已部分被空气中的氧气氧化 | |
| C. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| D. | 此实验能确定Na2SO3是否被部分氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3→NaCl | B. | SO3→H2SO4 | C. | MgO→Mg(OH)2 | D. | CaCO3→Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na分离开 | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 当光束通过该分散系时,可以看到一条光亮的“通路” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
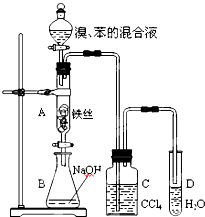 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.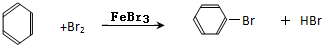 .
.| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com