
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、NO3-、I- | B. | H+、Ag+、NO3-、HCO3- | ||
| C. | Fe3+、Na+、S2-、Cl- | D. | Al3+、K+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
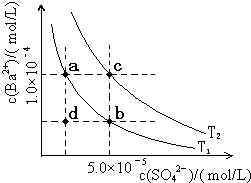 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
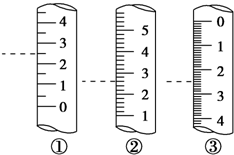 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
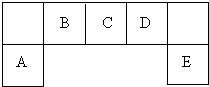
 元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
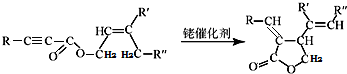
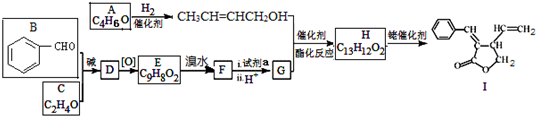
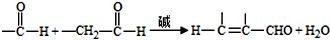
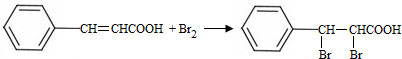 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.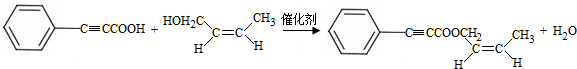 .
.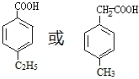 (写出一种即可).
(写出一种即可). 和CH3CHO为原料合成
和CH3CHO为原料合成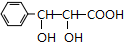 的合成路线流程图:
的合成路线流程图: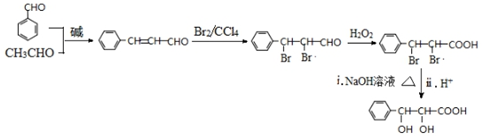 .(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
.(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用氨气制硝酸属于人工固氮 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 常温下,运输浓H2SO4、浓HNO3时可用铝制或铁制槽车 | |
| D. | 硅可用于制造光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com