
| A. | 淀粉(氯化钠)渗析 | |
| B. | 硬脂酸钠(甘油溶液)盐析、过滤 | |
| C. | 水(鸡蛋清)蒸馏 | |
| D. | 蔗糖(葡萄糖)与银氨溶液混合水浴加热,过滤 |
科目:高中化学 来源: 题型:填空题
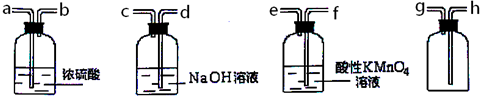
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

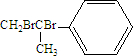 ,化合物Ⅱ完全燃烧消耗O211.5 mol.
,化合物Ⅱ完全燃烧消耗O211.5 mol.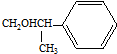 .化合物Ⅳ与新制Cu(OH)2反应的化学方程式
.化合物Ⅳ与新制Cu(OH)2反应的化学方程式 .
.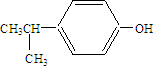 .
.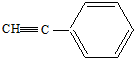 能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为
能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为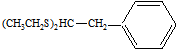 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯化反应的反应物之一肯定是醇 | B. | 酯化反应一般不需要加热 | ||
| C. | 酯化反应是有限度的 | D. | 酯化反应一般需要催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
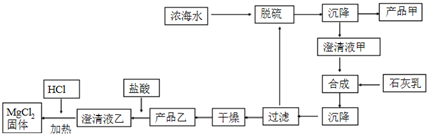
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得该消毒液的pH约为12 | |
| B. | 该消毒液中,Fe3+、K+、NO${\;}_{3}^{-}$、CH3CHO可以大量共存 | |
| C. | 向该消毒液中滴入少量Na2SO3溶液,反应的离子方程为:SO${\;}_{3}^{2-}$+ClO-=Cl-+SO${\;}_{4}^{2-}$ | |
| D. | 向该消毒液中加入浓盐酸,每产生1mol Cl2,转移电子数约为2×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com