
用NA表示阿伏加德罗常数。下列叙述正确的是……………( )
A.1mol乙烯分子中含有的共用电子对的数目为5NA
B.42g乙烯与丙烯的混合气体中含碳原子数为3NA
C.标准状况下,22.4L己烷中碳碳键数目为5NA
D.乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6 NA
科目:高中化学 来源: 题型:
一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.16∶25
C.2∶1 D.1∶7

查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。

填写下列空白:
(1)A中所含单质为 Fe、Al、Si、C (写化学式)。
(2)写出A中的某单质与烧碱溶液反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)若用长滴管向浅绿色溶液H中加入NaOH溶液产生的现象是________________________________________________________________________
________________________________________________________________________。
(4)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是弱电解质的是
A.熔化时不能导电 B.不是离子化合物是共价化合物
C.水溶液的导电能力很差
D.溶液中存在电离平衡,电离出的离子和未电离的分子共存
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”、“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”、“等于”),此时溶液中离子浓度由大到小的顺序是______________________。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于烯烃和炔烃相比较的说法,不正确的是( )
A、含元素种类相同,但通式不同

C、烯烃分子含碳原子数≥2,烷烃分子含碳原子数≥1
D、碳原子数相同的烯烃分子和烷烃分子互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.已知25℃时部分弱电解质的电离平衡常数数据如下表
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、K a2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、K a2=1.02×10-7 |
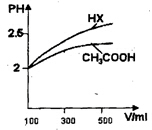 (1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________ _
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数_______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
 (4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
(4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
Ⅱ(5)过氧化尿素(CO(NH2)2·H2O2)是一种新型漂白、消毒剂,其活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
 完成并配平下列化学方程式:
完成并配平下列化学方程式:
MnO4— + H2O2 + H+ = Mn2+ + H2O +
② KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com