
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O15、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O15 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
________________________________________________________________________。
(2)催化氧化所使用的催化剂钒触媒(V2O15)能加快二氧化硫的氧化速率,此过程中产生了一连串的中间体(如图1)。其中a、c两步的化学方程式可表示为________________________,________________________________。

(3)该工艺中沉钒率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵的系数(NH4Cl加入质量与料液中V2O15的质量比)和温度。根据图2和图3,试建议控制氯化铵系数和温度的适宜值分别为________、________。
解析 (1)根据表格信息,V2O15难溶于水,被亚硫酸钠还原成可溶于水的VOSO4,离子方程式为V2O15+SO+4H+===2VO2++SO+2H2O。(2)V2O15是催化剂,反应前后质量和化学性质不变。依题意和物质转化图知,a反应:五氧化二钒与二氧化硫反应生成三氧化硫和四氧化二钒;c反应:VOSO4在氧气作用下生成V2O15和SO3。(3)根据图像知,加氯化铵系数为4、温度为80 ℃时沉钒率最大。
答案 (1)V2O15+SO+4H+===2VO2++SO+2H2O (2)SO2+V2O15SO3+V2O4 4VOSO4+O22V2O15+4SO3 (3)4 80 ℃


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
已知X、Y是阳离子,Z是阴离子,M、N是分子,它们都由短周期元素组成,且具有以下结构特征和性质:①X、Y、M、N的核外电子总数相等;②常温下,M是极易溶于N的气体;③X与M均由相同的元素组成;④Y为单核离子,其与Z组成的物质可用于净水;⑤Z由同主族元素组成。请回答下列问题:
(1)X的电子式为______________________,Z的离子符号为______________________。
(2)X与Z形成的化合物中所含有的化学键类型为______________________。
(3)写出Y与M、N形成的混合物发生反应的离子方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)( )
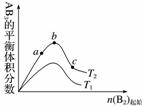
由此可得出的结论是
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为b>a>c
C.若T2>T1,则正反应一定是放热反应
D.达到平衡时,AB3的物质的量大小为c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
 |
回答下列问题:
①操作II所包含的两项主要基本操作是 。 上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为 。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式: 。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为: ,该滴定过程中 (填“是”或“否”)还需要指示剂。
实验步骤如下:
a. 考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加 溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c. 量取25.00mL待测溶液于锥形瓶中;
d. 用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
② 某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
| 方案 | 现象或产物 |
| |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 | ||
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )。
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是 ( )。
A.反应后生成的盐只为Fe(NO3)3
B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为某轻质纯碱产品说明书:
|
| 化学名:碳酸钠,俗称苏打 |
| 性状:白色粉末,易溶于水,水溶液呈中性 | |
| 化学式:Na2CO3 | |
| 用途:重要的基本化工原料之一,在纺织、玻璃、制皂、造纸等领域都有广泛应用 |
其中有错误的一项是 ( )。
A.化学名 B.性状
C.化学式 D.用途
查看答案和解析>>
科目:高中化学 来源: 题型:
稀氨水中存在着下列平衡:NH3·H2O??NH +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
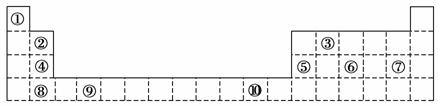
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为________;该元素与元素①形成的最简单分子X属于________分子(填“极性”或“非极性”)。
(4)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)元素⑩的基态原子核外电子排布式是________。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com