
分析 (1)根据吸热反应中,△H>0,根据燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,产物为稳定氧化物以及热化学方程式②解答该题;
(2)①0.4mol液态肼和足量液态H2O2反应生成氮气和水蒸气时放出256.64kJ的热量,1mol液态肼完全反应放出的热量=$\frac{256.64kJ}{0.4mol}$=641.6kJ/mol;
②16g肼的物质的量=$\frac{16g}{32g/mol}$=0.5mol,H2O(1)=H2O(g)△H=+44kJ/mol,根据盖斯定律计算其放出的热量;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
根据盖斯定律将方程式2×②-①计算得到.
解答 解:(1)吸热反应中,△H>0,属于吸热反应的是③;燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,产物为稳定氧化物,由C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol可知碳的燃烧热△H=-393.5kJ/mol;
故答案为:③;-393.5;
(2)①0.4mol液态肼和足量液态H2O2反应生成氮气和水蒸气时放出256.64kJ的热量,1mol液态肼完全反应放出的热量=$\frac{256.64kJ}{0.4mol}$=641.6kJ/mol,其热化学反应方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6kJ/mol;
(2)16g肼的物质的量=$\frac{16g}{32g/mol}$=0.5mol,
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6kJ/mol①,
H2O(1)=H2O(g)△H=+44kJ/mol②,
①-4×②得N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.kJ/mol,
所以0.5mol肼和双氧水反应生成氮气和液态水放出817.6×0.5=408.8kJ热量,
故答案为:408.8kJ;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
根据盖斯定律将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2×(-534KJ•mol-1
)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1.
点评 本题考查了化学反应中热效应、热化学方程式的书写以及燃烧热的概念,题目较简单,注意盖斯定律的应用是解题的关键.


科目:高中化学 来源: 题型:解答题
 莫尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取莫尔盐,实验步骤如下:
莫尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取莫尔盐,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | 易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 是有色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液 | B. | 氢氧化钠溶液 | C. | 醋酸钠固体 | D. | 碳酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,储氢合金作负极 | |
| B. | 电池充电时,阳极发生氧化反应 | |
| C. | 电池工作时,负极反应式:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 电池放电时,电子由正极通过外电路流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
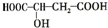 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1 mol苹果酸能与3 mol的Na发生反应 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗3mol Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com