
| A、无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等 |
| B、和酸反应生成盐和水的物质一定是碱性氧化物 |
| C、所有的酸性氧化物都可以与水化合得到相应的酸 |
| D、根据溶解性的不同,可将碱分为难溶性碱和可溶性碱 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
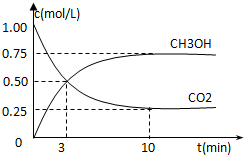 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
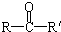 (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.
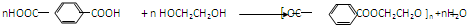
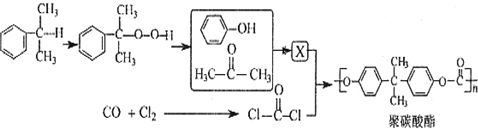
 反应合成聚碳酸酯的化学方程式(不必写反应条件):
反应合成聚碳酸酯的化学方程式(不必写反应条件):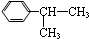 互为同分异构体的有机物有
互为同分异构体的有机物有查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
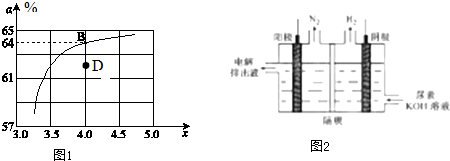
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:
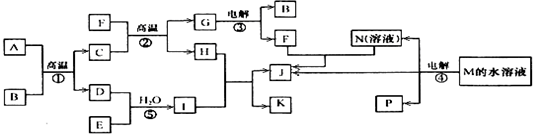
| B |
| H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com