
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(CH3COOH)+c(CH3COO-)=0.1 mol/L |
| C、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |


科目:高中化学 来源: 题型:
 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-→2Fe2++I2 |
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的氢硫酸溶液中含有的H2S分子数为NA |
| B、将1molNa2CO3溶于1L 水后,所得溶液中含有CO32-离子数为NA |
| C、电解NaCl溶液时,阳极上析出22.4L氯气,转移电子数为2NA |
| D、pH=13的1.0 L Ba(OH)2溶液中含有的OH-数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、SO42-、NH3?H2O |
| B、K+、Al3+、MnO4-、C2H5OH |
| C、K+、Cl-、NO3-、Fe2+ |
| D、Na+、NH4+、NO3-、CH3OOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置模拟铁的吸氧腐蚀 |
| B、图2装置制取并吸收NH3 |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置制取少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
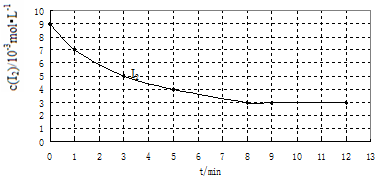
| 实验 编号 |
实验目的 | 温度/℃ | 催化剂 质量/g |
反应物初始浓度 /10-3mol?L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下两个实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 0 | 7 | 9 | |
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插到硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
| B、铜与稀硫酸反应:Cu+2H+=Cu2++H2↑ |
| C、碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O |
| D、氢氧化钡溶液与稀硫酸混合:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com