
分析 (1)根据NaOH溶液与FeCl2溶液先后发生反应:FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,可观察到产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀;
(2)①根据Cl2做氧化剂被还原生成氯离子,Fe3+被氧化为FeO42-,确定反应物和生成物,然后根据化合价升降总数相等和原子守恒配平;
②SCN-中S为负二价,N为负三价均为最低价有被氧化的可能,溶液的颜色会逐渐褪去,可能溶液中的SCN-被过量的氯水氧化;
(3)FeSO4溶液,在空气中放置一段时间后,被空气中的氧气氧化生成硫酸铁和氢氧化铁的红褐色浑浊.
解答 解:(1)NaOH溶液与FeCl2溶液先后发生反应:FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,可观察到产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀,
故答案:产生白色沉淀,迅速变灰绿色,最终变红棕色沉淀;FeCl2+2NaOH═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(2)①Cl2做氧化剂被还原生成氯离子,Fe3+被氧化为FeO42-,根据化合价升降总数相等和原子守恒得:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
②SCN-中S为负二价,N为负三价均为最低价有被氧化的可能,溶液的颜色会逐渐褪去,可能溶液中的SCN-被过量的氯水氧化,
故答案为:SCN-被Cl2氧化;
(3)FeSO4溶液,在空气中放置一段时间后,被空气中的氧气氧化生成硫酸铁和氢氧化铁的红褐色浑浊,反应方程式为:12 FeSO4+3O2+6H2O=4Fe2(SO4) 3+4 Fe(OH)3↓,故答案为:12 FeSO4+3O2+6H2O=4Fe2(SO4) 3+4 Fe(OH)3↓.
点评 本题是实验探究题,难度中等,解题需正确获取题干信息并能灵活运用所学化学知识,进行分析问题、解决问题.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
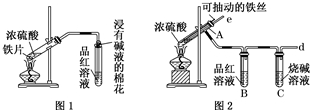 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
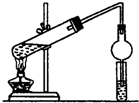
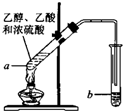 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
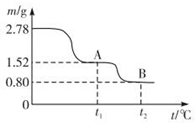
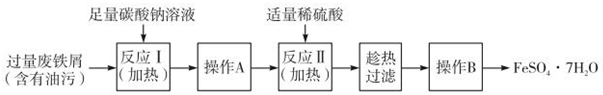
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.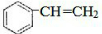 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为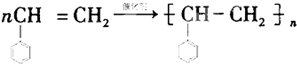 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
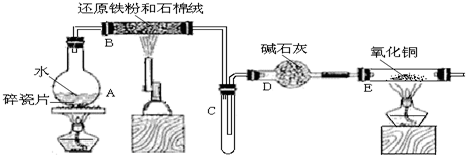
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
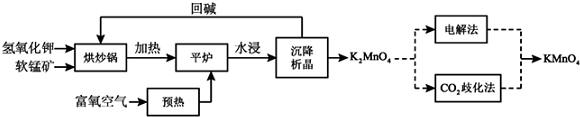
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
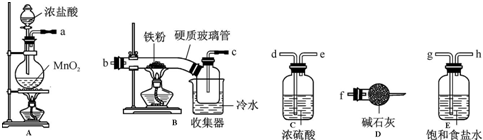
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com