
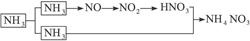
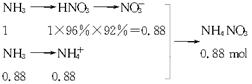
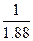 ×100%=53%
×100%=53%

科目:高中化学 来源:不详 题型:填空题

 HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3易液化,液氨常用作制冷剂 |
| B.与金属反应时,稀HNO3可被还原为低价态的氮的化合物 |
| C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 |
| D.稀HNO3和活泼金属反应时主要得到氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定显酸性 |
| B.一定显碱性 |
| C.可能显酸性,可能显碱性,也可能显中性 |
| D.以上都不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①>② | B.①<② | C.①="②" | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )之比为6:1,则Cl2与NaOH溶液反应时,被氧化的氯气的体积分数为( )
)之比为6:1,则Cl2与NaOH溶液反应时,被氧化的氯气的体积分数为( )| A.0.25 | B.0.50 | C.0.75 | D.0.80 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气的性质很活泼,它与氢气混合后立即发生爆炸 |
| B.漂白粉是一种混合物,它的有效成分是氯化钙和次氯酸 |
| C.漂白液和漂白粉的成分完全相同 |
| D.氯水经光照后有气泡逸出,若将该气体收集起来,它能使带火星的木条复燃 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiC的硬度很大,可用作砂纸、砂轮的磨料 |
| B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| C.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
| D.过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com