
(12分,每空2分)一定的条件下,在某一容积为2L的密闭容器内,物质A、B、C发生某种放热化学反应,反应中物质A、B、C的浓度随时间变化情况如图1:

(1)该反应化学方程式为_____________________________________,该反应的逆反应化学平衡常数表达式为___________;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(C)为________________;
(3)反应达到平衡后,第8分钟时:
①若升高温度,C浓度的变化正确________;(用图2中a~f的编号回答)
②若加入B,该反应的平衡常数将____________。(填“增大”或“不变”或“减小”)
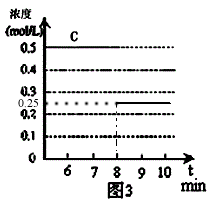
(4)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中用“粗线条”画出8分钟后C浓度的变化情况。
(每空2分,总计12分)
(1)A + B 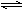 2C;
2C; 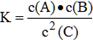
(2)0.167mol/(L?min)或0.17mol/(L?min);
(3)① c; ② 不变。
(4)
【解析】
试题分析:(1)开始反应时反应物的浓度减少,生成物的浓度增大,最后浓度都不再变化,故A、B是反应物,C是生成物,根据化学计量数之比只与反应的物质的量之比,因此,反应方程式为:A + B 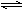 2C。化学平衡常熟等于反应物的浓度幂之积除以生成物的浓度幂之积的值,故逆反应化学平衡常数表达式为
2C。化学平衡常熟等于反应物的浓度幂之积除以生成物的浓度幂之积的值,故逆反应化学平衡常数表达式为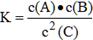 。
。
(2)根据公式计算,v(C)=? c(C)/?t=0.5(mol/L)/3min=0.167mol/(L?min)。
(3)①升高温度,化学平衡逆向移动,C的浓度会减少,故c图像是正确的。
②平衡常数只与温度有关,故平衡常数不变。
(4)反应是前后气体体积不变的反应,改变容器的体积(气体的压强),化学平衡不移动,体积扩大一倍,物质的浓度都减少一半。
考点:化学反应速率的计算化学平衡的移动化学平衡常数
点评:本题考查了反应速率、平衡常数计算和平衡移动,难度适中,注意化学平衡常数与温度有关。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源:2011-2012学年江西省上高二中高一上学期第二次月考化学试卷 题型:填空题
(12分,每空2分)(Ⅰ)写出下列物质在水溶液中的电离方程式:
NaHSO4 , K2SO4 ,
NH4NO3 , Al2(SO4)3 ___________________________________。
(Ⅱ)将下列离子反应,改写成对应的化学方程式:
(1)Cu + 2Ag+ = Cu2++ 2Ag;___________________________________
(2) CaCO3 + 2H+ = CO2↑+ H2O +Ca2+;_______________ ________________
________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省大同市实验中学高一第一次月考化学试卷(带解析) 题型:填空题
(12分,每空2分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: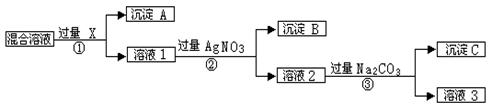 请回答下列问题:
请回答下列问题:
[1]写出实验流程中下列物质的化学式
试剂X : 沉淀A: 沉淀B:
[2]上述实验流程中加入过量的Na2CO3的目的是 _____ 。
[3]写出③的化学方程式:②________________________________________
[4]按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三8月月考化学试卷(解析版) 题型:填空题
(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899 |
1 757 |
14 840 |
21 000 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
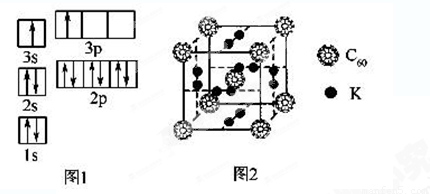
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一上学期第二次月考化学试卷 题型:填空题
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
⑴人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+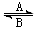 Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。
Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。
⑵“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作 剂,具有 性。
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为 ;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com