
【题目】2016年2月《Nature》报道的一种四室(1#~4#)自供电从低浓度废水中回收铜等重金属的装置如下图所示:
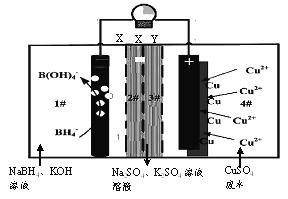
下列说法正确的是
A. 装置工作时,4#室中溶液pH不变
B. X、Y依次为阴离子、阳离子选择性交换膜
C. 负极的电极反应为:BH4-+8OH--8e-=B(OH)4-+4H2O
D. 单位时间内4n(NaBH4)消耗>n(Cu)生成是由于负极上有O2析出
【答案】C
【解析】
A.根据图示可知:1#室中BH4-失去电子变为B(OH)4-,电子由负极经外电路转移到正极上,4#室中Cu2+获得电子变为单质Cu析出,CuSO4是强酸弱碱盐,Cu2+水解使溶液显酸性,Cu2+浓度降低,溶液的酸性减弱,因此pH增大,A错误;
B.根据图示可知:左边的1#室溶液中的K+、Na+通过X膜进入2#室、3#室,所以X膜为阳离子膜;4#室中SO42-通过Y膜进入到3#室,所以Y膜为阴离子膜,B错误;
C.根据图示可知负极上BH4-失去电子变为B(OH)4-,因此负极的电极反应为:BH4-+8OH--8e-=B(OH)4-+4H2O,C正确;
D.每1molBH4-失去8mole-,而每1molCu2+获得2mol电子,所以若单位时间内4n(NaBH4)消耗>n(Cu)生成是由于正极上有H2析出,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】根据要求填空:
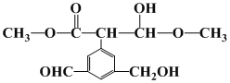
(1)下图物质经足量H2加成后的产物中,含手性碳原子(连有四个不同的原子或原子团)个数为__________。
(2)某高分子结构简式为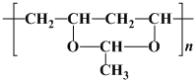 ,它是由
,它是由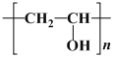 与另一单体X经缩合反应得到的。已知缩合过程中有H2O生成,则单体X的结构简式可能为________________
与另一单体X经缩合反应得到的。已知缩合过程中有H2O生成,则单体X的结构简式可能为________________
(3)1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC,B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
①B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
②C是对位二元取代的芳香族化合物,写出A的结构简式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
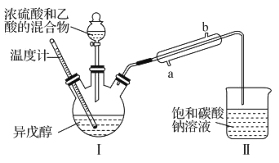
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. Mg(OH)2(s)![]() MgCl2(aq)
MgCl2(aq)![]() Mg(s)
Mg(s)
B. FeCl2(aq)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(OH)3(胶体)
Fe(OH)3(胶体)
C. 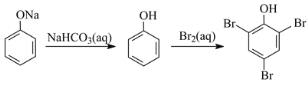
D. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究![]() 溶液和
溶液和![]() 溶液的反应原理。
溶液的反应原理。
(实验一)将含淀粉的![]() 溶液加入
溶液加入![]() 酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明![]() 具有__________性。
具有__________性。
(2)查阅文献:
反应Ⅰ:![]() 慢
慢
反应Ⅱ:![]() _____=_____+_____ 较快
_____=_____+_____ 较快
反应Ⅲ:![]() 快
快
写出酸性条件下,反应Ⅱ的离子方程式__________。
(3)向实验一所得蓝色溶液中加入少量![]() 溶液,蓝色迅速褪去,后又变蓝色。据此得出
溶液,蓝色迅速褪去,后又变蓝色。据此得出![]() 氧化性比
氧化性比![]() 强,该结论______(填“合理”或“不合理”),理由是_________。
强,该结论______(填“合理”或“不合理”),理由是_________。
(4)为了进一步研究![]() 溶液和
溶液和![]() 溶液的反应原理,设计如下实验。
溶液的反应原理,设计如下实验。
(实验二)装置如图所示,![]() 闭合后,电流表的指针偏转情况记录如表:
闭合后,电流表的指针偏转情况记录如表:
表盘 |
|
| ||
时间/min |
|
|
| |
偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
①![]() 闭合后,检验b极附近溶液存在放电产物
闭合后,检验b极附近溶液存在放电产物![]() 的实验操作是__________。
的实验操作是__________。
②![]() 时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断
时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断![]() 在a极放电的产物是__________。
在a极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致![]() 难与
难与![]() 发生反应
发生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
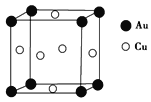
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com