
| A. | 18g重水(D2O)所含的电子数为10NA | |
| B. | 常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA |
分析 A.D2O中含有10个电子,摩尔质量是20g/mol;
B.结合3NO2+H2O=2HNO3+NO反应中,3molNO2反应转移电子2mol;
C.标准状况下气体摩尔体积为22.4L/mol;
D.常温下,1L 0.1mol/L CH3COONa溶液中溶质物质的量=1L×0.1mol/L=0.1mol,Na+离子数为0.1NA .
解答 解:A.18g重水(D2O)的物质的量是=$\frac{18g}{20g/mol}$=0.9mol,D2O分子中含有10个电子,含有的电子数为10NA,18g重水(D2O)所含的电子数为0.9NA,故A错误;
B.3NO2+H2O=2HNO3+NO反应中,3molNO2反应转移电子2mol,0.3mol NO2完全与水反应,转移的电子教为0.2NA,故B正确;
C.四氯化碳标准状况不是气体,22.4L CCl4中物质的量不是1mol,故C错误;
D.常温下,1L 0.1mol/L CH3COONa溶液中溶质物质的量=1L×0.1mol/L=0.1mol,Na+离子数为0.1NA ,故D正确;
故选BD.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和微粒数的计算关系,气体摩尔体积条件应用、氧化还原反应电子转移等知识点,掌握基础是解题关键,题目难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中混有Ba(OH)2(CuSO4) | B. | Cu(NO3)2溶液中混有AgNO3(铜粉) | ||
| C. | CO2中混有CO(炽热的炭) | D. | CO2中混有HCl气体(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2═Mg2++2Cl- | B. | Fe2(SO4)3═2Fe3++3SO42- | ||
| C. | NaHCO3═Na++H++CO32- | D. | KHSO4═K++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝铵与草木灰不能混合使用,否则将使前者失去肥效,而后者仍有肥效 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 可用于制作航天服的聚酯纤维是新型无机非金属材料 | |
| D. | 采用“静电除尘”、“原煤脱硫”、“汽车尾气催化净化”等方法,可提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl2+Cl2═2FeCl3,反应中氧化产物和还原产物质量比为1:1 | |
| B. | 根据反应I2+SO2+2H2O═H2SO4+2HI,说明还原性SO2<HI | |
| C. | 8NH3+3Cl2═6NH4Cl+N2中氧化剂和还原剂物质的量之比为3:8 | |
| D. | KClO3+6HCl═3Cl2+KCl+3H2O,每生成3molCl2,转移电子6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10的氧原子:810O | B. | 氧负离子(O2-)的结构示意图: | ||
| C. | Na2O2的电子式: | D. | 1-丙醇的结构简式: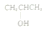 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
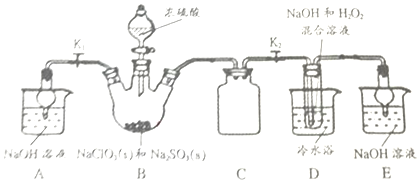
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+SO32-Cl- | B. | Cu2+SO42-NO3- | C. | Na+K+I- | D. | Ag+Br-Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期中的 18 种元素具有重要的用途.
第四周期中的 18 种元素具有重要的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com