
 NOx是大气污染的主要污染物之一.
NOx是大气污染的主要污染物之一.
| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 转变为
转变为 的最佳方法是( )
的最佳方法是( )| A、与稀H2SO4共热后,加入足量的NaOH溶液 |
| B、与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| C、与足量的NaOH溶液共热后,再通入足量的CO2 |
| D、与足量的NaOH溶液共热后,再加入适量的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |

| 催化剂 |
| △ |
 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室合成乙酸乙酯粗产品的步骤如下:
实验室合成乙酸乙酯粗产品的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl不溶于水,不能转化为AgI |
| B、一定温度下,向AgCl的饱和溶液中加入NaCl固体,有AgCl固体析出 |
| C、AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
| D、向AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于复分解反应 |
| B、该反应不是氧化还原反应 |
| C、若管道漏气遇氨就会产生白烟 |
| D、生成1 mol N2有3 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (提示:环丁烷
(提示:环丁烷 可简写成
可简写成 )
)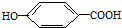 ),其反应类型
),其反应类型查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com