
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是
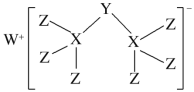
A.W的最高价氧化物是离子化合物
B.该新化合物中X满足8电子稳定结构
C.元素非金属性的顺序为X>Y>Z
D.Z的最高价氧化物的水化物是强酸
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________,过氧化氢的电子式为__________________。
(2)写出反应的热化学方程式:________________________________________________。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O===O | H—H | H—O(g) | |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式___________________________________________;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)_____________________________。
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_____________mol·L-1(填精确值)。
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为_______________________(用含代数a、b等表示)。
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=________
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式____________________
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氯化铝溶液蒸干灼烧得到的固体物质是(填化学式)____________向纯碱溶液中滴入几滴酚酞会变红,原因是(用离子方程式表示)_______________ 。
(2)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着。它在唾液中存在下列平衡:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应 X(g)+3Y(g)![]() 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
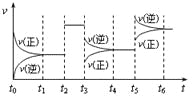
A. t2时加入了催化剂
B. t3时减小了体系压强
C. t5时升高了体系温度
D. t2、t3、t5变化后反应物转化率均比t1时减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。

已知:i. 
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________

(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:
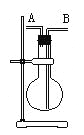
① H2②Cl2③CH4④HCl ⑤NH3⑥NO ⑦NO2⑧SO2,
下列操作正确的是
A. 烧瓶是干燥的,由A进气收集①③⑤
B. 烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C. 在烧瓶中充满水,由A进气收集①③⑤⑦
D. 在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com