
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
分析 水的电离方程式为:H2O?H++OH-,常温下,一定浓度的某溶液由水电离出的c(OH-)=10-3 mol/L>10-7mol/L,说明该物质促进水电离,则为含有弱离子的盐,据此分析解答.
解答 解:酸或碱抑制水电离,含有弱离子的盐促进水电离,常温下,一定浓度的某溶液由水电离出的c(OH-)=10-3 mol/L>10-7mol/L,说明该物质促进水电离,则为含有弱离子的盐,
①硫化氢的溶液为弱酸溶液,抑制水电离,故①错误;
②氯化铝属于强酸弱碱盐,能水解而促进水电离,故②正确;
③硫酸铁属于强酸弱碱盐,能水解而促进水电离,故③正确;
④氢氧化钠是碱,抑制水电离,故④错误;
故选C.
点评 本题以盐类水解为载体考查水的电离,明确哪些物质抑制水电离、哪些物质促进水电离即可解答,注意弱碱强酸盐溶液呈酸性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
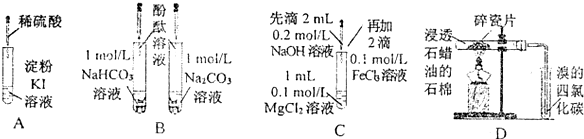
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
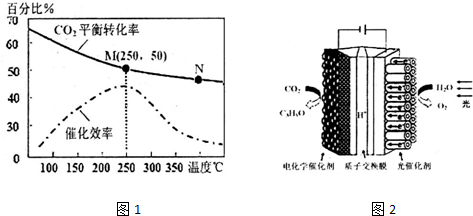
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
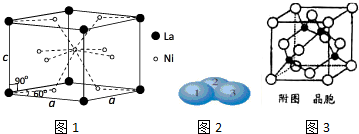
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com