
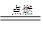 2H2O,试回答下列问题。
2H2O,试回答下列问题。 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol  S (g) + 2H2O (g) ΔH =+90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+90.4 kJ/mol CH3OH (g) ΔH=-90.8 kJ/mol
CH3OH (g) ΔH=-90.8 kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
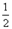 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1
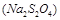 的作用: 。
的作用: 。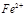 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与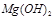 反应。虽然
反应。虽然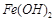 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将 除去并获得纯度高的
除去并获得纯度高的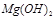 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ;| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
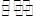 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。| 化学键 | H—H | N—H | N=N |
| 键能(kJ/mol) | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据热化学方程式,燃烧1mol S放出的热量为297.23 kJ |
| B.形成1 mol SO2的化学键所释放的总能量大于断裂 1 mol S ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
| C.S ( g ) + O2 ( g ) = SO2 ( g )△H =-Q kJ/mol则Q>297.23 |
| D.S ( g ) + O2 ( g ) = SO2 ( g )△H =-Q kJ/mol则Q<297.23 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 0分)汽车尾气中含有CO、NO2
0分)汽车尾气中含有CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。 (g) ΔH=-393.5 kJ·mol-1
(g) ΔH=-393.5 kJ·mol-1 ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲
ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲  (填代号)。
(填代号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol
2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com