
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
分析 △H为化学反应的焓变,放热反应的△H<0,吸热反应的△H>0;反应的热效应与反应物和生成物的状态有关,反应放出热量越大,焓变数值越小,据此进行解答.
解答 解:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2 ,两个反应都是放热反应,后者生成液态水,所以后者放出的热量大于前者,而放热反应△H小于0,放热越多,焓变值越小,故△H1>△H2;
②NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H3、NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H4.两个反应的实质是酸碱中和,都是放热反应,两个反应生成水的物质的量都是1mol,但是CH3COOH(aq)是弱电解质,电离过程吸收一部分热量,所以后者放出的热量小,所以△H3<△H4,
故选B.
点评 本题考查了反应热大小的比较,题目难度不大,明确反应热与焓变的关系为解答关键,注意掌握焓变的正负号及影响反应热的因素,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:推断题
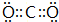 ,
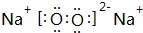
,
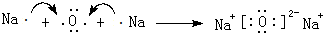 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
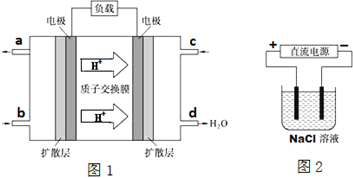
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.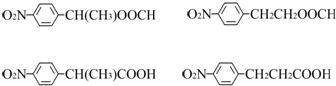 任意2种.
任意2种.
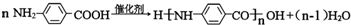 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 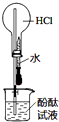 如图实验可观察到红色喷泉 | |
| B. | 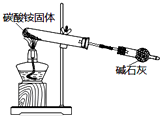 如图实验可制取少量氨气 | |
| C. | 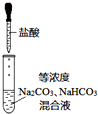 如图实验中逐滴滴加稀盐酸时,试管中立即产生大量气泡 | |
| D. | 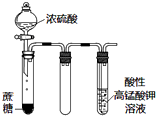 如图实验中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变 |
查看答案和解析>>
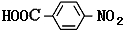
科目:高中化学 来源: 题型:解答题
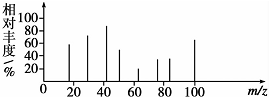
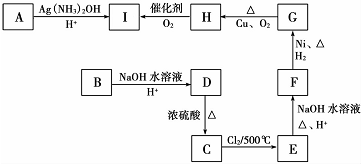
 、HOCH2CH2CH2CH2COOH.
、HOCH2CH2CH2CH2COOH. 、
、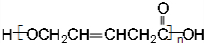 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
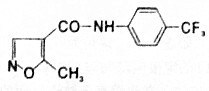
| A. | 分子式为C12H10F3N2O2 | B. | 可以发生水解反应和氧化反应 | ||
| C. | 该化合物易溶于水,难溶于酒精 | D. | 该化合物所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
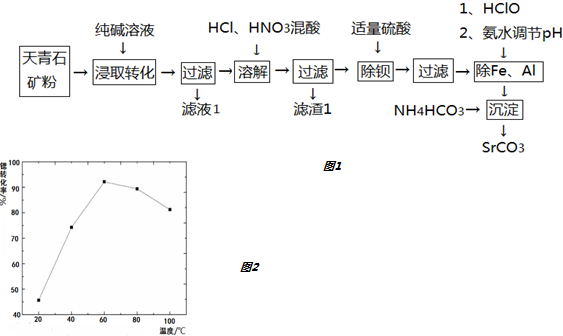
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com